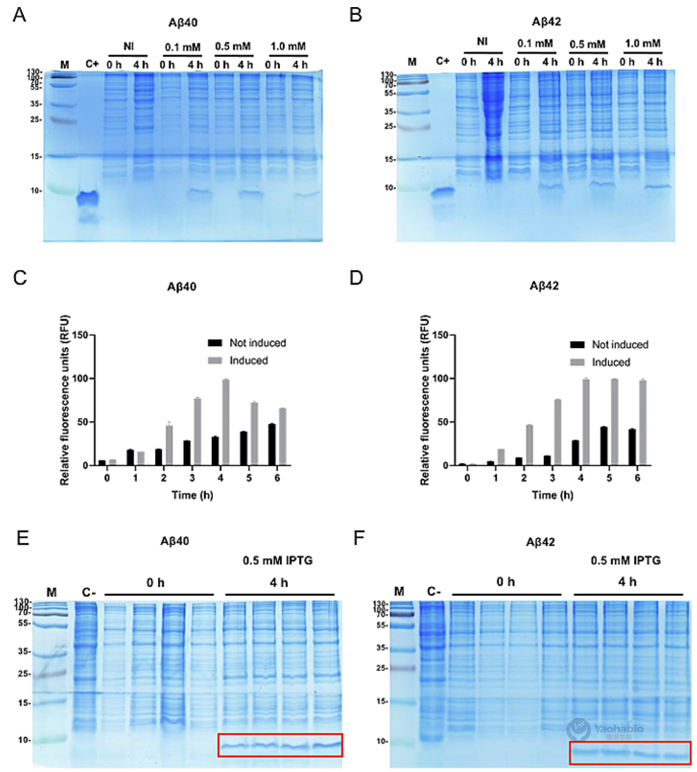
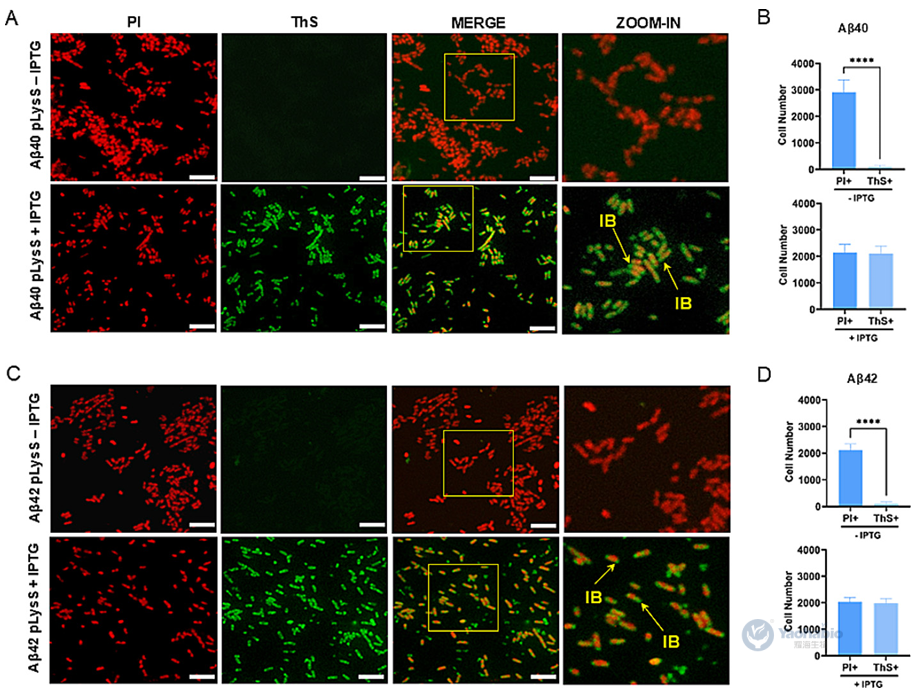
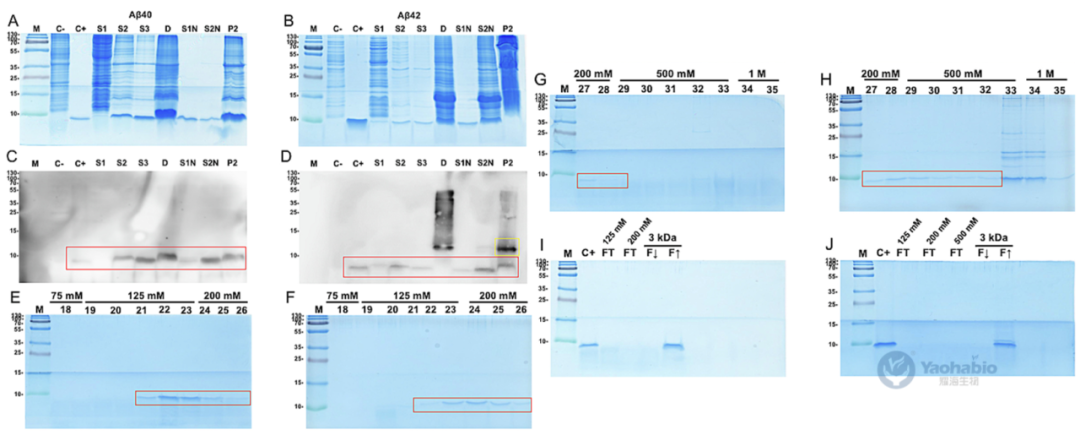
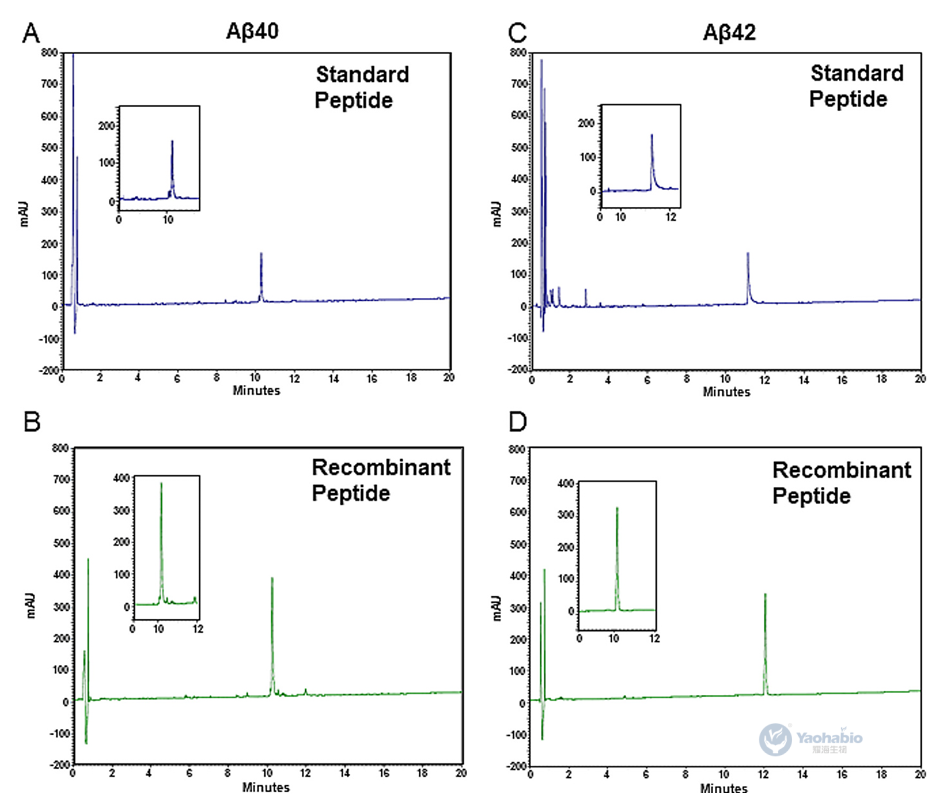
耀海前沿 | 通过包涵体形成和荧光监测简化大肠杆菌中Aβ的表达与纯化
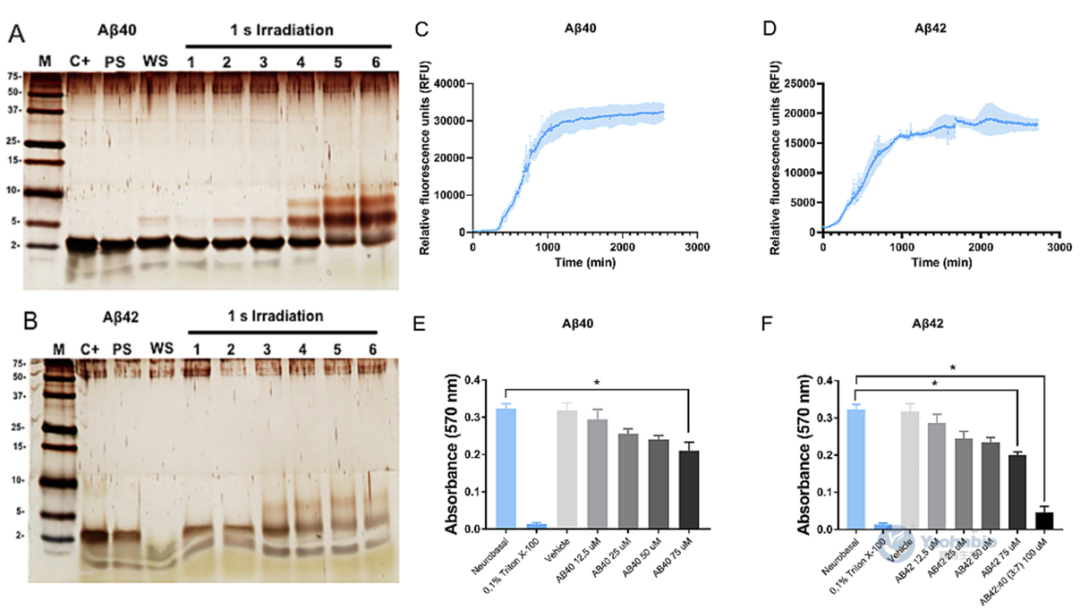
β-淀粉样蛋白(Amyloid-beta, Aβ)的重组生产因在细菌宿主中易聚集且具细胞毒性而面临挑战。2025年9月,有学者在Journal Of Microbiological Methods上发表题为“Streamlined E. coli expression and purification of amyloid beta peptides via inclusion body formation and fluorescence monitoring”的研究型文章。作者在本研究中,提出一种简化可重复的方法,用于在大肠杆菌BL21(DE3) pLysS中表达和纯化蛋氨酸修饰的Aβ40与Aβ42肽。该研究利用包涵体(Inclusion body, IB)形成特性提升产量并简化纯化,关键创新在于结合硫黄素-S(Thioflavin S, ThS)与碘化丙啶(Propidium iodide, PI)的实时荧光光谱及显微镜技术,实现对IB形成与表达动态的非侵入性监测。通过调节pH值、阴离子交换色谱及超滤完成纯化后,Aβ40、Aβ42的平均浓度分别达3.2±1.3mg/L、4.8±3.2mg/L,HPLC证实二者平均纯度分别为90.2%±0.8%、84.0%±17.4%。经光诱导化学交联方法、硫黄素-T(Thioflavin T, ThT)荧光测定及原代海马神经元毒性测试验证,所得肽段结构完整且具生物活性。该无标签、经济高效的平台为Aβ肽生产提供可扩展方案,可推动其在结构生物学、神经退行性疾病研究及高通量药物筛选中的应用。 01 一、引言 易聚集肽的重组生产面临表达、溶解及纯化挑战。酵母与哺乳动物系统虽具翻译后修饰优势,但成本高、表达量低。大肠杆菌因易操作、可扩展且产量高,仍是首选宿主,但其表达的易聚集肽易形成IB,引发细胞毒性并降低产量。Aβ肽是阿尔茨海默病关键成分,疏水相互作用强、聚集倾向高,重组表达难度大。现有方法通过蛋氨酸修饰促进IB形成以辅助纯化,但缺乏实时监测IB形成的手段,且依赖亲和色谱或酶切步骤,流程复杂。IB若管理得当可简化纯化,传统终点分析无法实时控制表达过程,而荧光技术可动态追踪IB形成。基于此作者开展该研究,提出在大肠杆菌BL21(DE3)pLysS中表达纯化蛋氨酸修饰Aβ40/42的简化方法,集成ThS/PI的实时荧光监测,结合生物物理及功能测定验证肽活性,旨在为易聚集肽生产提供高效方案。 02 二、Aβ肽在大肠杆菌BL21中的表达与荧光监测 / 作者选用pET-Sac-Aβ(M1–40)与pET-Sac-Aβ(M1–42)质粒,因其编码蛋氨酸修饰形式的Aβ肽,有助于促进包涵体形成并简化下游纯化流程。该构建体此前已在细菌系统中验证可用于功能性Aβ表达,能够保证高产率与生物学相关性。研究采用热休克法将质粒转化至BL21(DE3) pLysS感受态大肠杆菌,转化菌株在含氨苄青霉素与氯霉素的LB琼脂平板上筛选获得阳性克隆。经聚合酶链式反应(Polymerase chain reaction, PCR)扩增与测序验证,确认转化菌中存在目标基因,其序列与参考序列完全一致。为优化Aβ肽的表达条件,作者比较了不同浓度异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-1-Thiogalactopyranoside, IPTG)诱导4小时后的表达效果。SDS-PAGE分析显示,在预期分子量位置出现特异性条带,与合成Aβ肽对照一致,而未诱导对照组无相应条带。通过密度定量分析发现,0.5mM IPTG诱导下蛋白表达量最高,而在1.0mM时表达反而下降;其中Aβ40的表达差异达到统计学显著水平。因此,该研究确定0.5mM IPTG为最佳诱导浓度。诱导后的菌体经离心收集、超声破碎、裂解液重悬与离心步骤,获得沉淀用于后续纯化。该表达体系的成功建立为重组Aβ肽的制备提供了可靠平台。 图1 人重组Aβ肽在大肠杆菌BL21(DE3)pLysS中的表达过程 作者还利用了ThS荧光染色法对大肠杆菌IB中Aβ肽的聚集行为进行了评估。通过建立Aβ40和Aβ42 IBs的激发与发射光谱,确保了检测的特异性,并可对比对照样品。时序分析显示,诱导4小时后荧光强度趋于稳定,表明肽表达达到平台期(图1C, D)。为促进ThS进入细胞,研究采用热休克法进行透化处理,以克服细菌膜完整性的限制。最后,在优化条件即0.5mM IPTG,诱导4h下,通过SDS-PAGE验证了该荧光检测结果,诱导样品中可见约4.6kDa的目标条带,而未诱导对照组无此条带(图1E, F),证实该荧光方法可有效监测Aβ肽的表达与聚集。 03 三、荧光显微镜证实大肠杆菌IB中的Aβ肽聚集 / 紧接着作者采用了荧光显微镜作为补充手段,在开展纯化前直接观察Aβ40与Aβ42肽在大肠杆菌中形成IB的情况。诱导4小时后,样品ThS/PI染色,其中ThS可穿透细菌膜并特异性结合具有β-片层结构的Aβ聚集体。在诱导菌体内可见绿色ThS荧光信号,多集中于细胞两极,表明IB内存在β-片层构象的Aβ聚集体;而未诱导细菌仅呈现微弱的背景荧光。为清晰区分细胞结构,作者同时使用PI对细菌DNA进行红色荧光复染,合并图像可明确分辨绿色IB与红色染色体(图2A, C)。进一步细胞计数分析显示,诱导组中ThS阳性细胞数与PI阳性细胞数无显著差异,而非诱导组ThS阳性细胞比例极低,具体为Aβ40与Aβ42均p<0.0001(图2B, D)。该结果证实ThS染色能特异、可靠地标识表达Aβ肽的细菌,为IB形成提供了直观的形态学证据。 图2 含有Aβ肽的包涵体荧光显微镜图像 04 四、Aβ肽的高效纯化 / 完成上述评估和监测之后,作者进一步建立了从大肠杆菌IB中高效纯化重组Aβ40和Aβ42肽的方案。首先是通过离心收集菌体,经裂解缓冲液重悬后,进行多轮超声破碎与离心以分离IB。SDS-PAGE显示随裂解循环推进,目标条带强度逐渐增加(图3A, B)。为提高回收率,引入第二轮变性-中和步骤,显著提升产量。Western Blot采用6E10单克隆抗体进行验证,在预期位置检出特异性条带,确认肽身份(图3C, D);部分样品中出现的额外条带可能为寡聚体。后续使用阴离子交换色谱进一步去除杂质,在125、200及500 mM NaCl洗脱组分中获得高纯度肽(图3E–H)。脱盐与超滤浓缩后,SDS-PAGE证实目标肽被有效保留且无损失(图3I, J)。 图3人重组Aβ肽的纯化 纯度与浓度通过紫外分光光度法及SDS-PAGE共同评估,五批次独立制备显示Aβ40平均产量为3.2±1.3mg/L,纯度达90.2%±0.8%;Aβ42平均产量为4.8±3.2mg/L,纯度为84.0%±17.4%,其较高变异度反映其易聚集特性。HPLC分析进一步确认重组肽与合成标准品保留时间一致,验证了产物的同一性与高纯度(图4A–D),为后续聚集行为及神经毒性研究奠定了基础。 图4 通过HPLC测定人重组Aβ肽的纯度 05 五、重组人Aβ肽保留其聚集和细胞毒性潜力 / 为了评估重组Aβ肽的聚集特性,作者采用了光诱导化学交联方法进行了分析。该技术可在RuBpy试剂存在下经短暂光照快速诱导Aβ40与Aβ42形成≥10 kDa的交联产物,提示二聚体及三聚体的生成(图5A, B)。进一步利用ThT荧光光谱监测β-片层结构形成动力学,结果显示聚集过程呈现典型的三相模式:成核期、延伸期及平台期(图5C, D)。研究表明,肽浓度越高,聚集进程越快,最终荧光强度也越高,说明重组Aβ具备显著的自组装倾向。 图5 重组Aβ肽的聚集能力和细胞毒性评估结果 文章的最后,作者评估了重组Aβ肽对原代大鼠海马神经元培养12天的神经毒性作用。将神经元暴露于浓度递增的Aβ40与Aβ42(12.5-75 μM)24小时后,细胞活力呈浓度依赖性下降,且在75 μM时出现统计学显著降低(图5E, F)。为模拟阿尔茨海默病脑中淀粉样蛋白组成,作者测试了Aβ42与Aβ40比例为3:7的混合肽。结果显示,该混合肽处理引起的细胞活力下降显著高于单一肽处理,表明Aβ40与Aβ42具有协同增强神经毒性的效应。 本研究建立了一种基于大肠杆菌IB的简化、无标签重组Aβ肽生产平台。该策略利用蛋氨酸修饰形式促进肽的定向聚集,并通过集成ThS/PI双色荧光显微技术,实现了对包涵体形成的实时、动态监测,有效克服了传统终点检测的局限性。纯化流程通过优化裂解、变性-中和、阴离子交换色谱及超滤等步骤,最终获得高纯度产物,其产量与基于融合标签的策略相当,但在操作复杂性和成本方面更具优势。进一步的功能分析证实,所获重组肽保留了其固有的淀粉样蛋白聚集特性,能够通过典型的三相动力学形成寡聚体与原纤维,并表现出对原代海马神经元的浓度依赖性神经毒性,尤其在模拟阿尔兹海默症脑内淀粉样蛋白组成的Aβ42:Aβ40混合比例下毒性协同增强。该平台为Aβ肽的相关研究提供了理化性质可靠、生物活性确凿的材料基础,在药物筛选、毒性机制解析及生物标志物开发等领域具有广泛应用前景。 耀海生物,作为一家专业领先的微生物表达体系合同研发与生产组织(CRDMO)服务提供商,致力于为广大客户提供专业、高效的生物技术服务。公司专注于以大肠杆菌和酵母菌表达体系,开展一系列生物制药的发酵、纯化、制剂工艺开发和生产的一站式外包服务。我们的服务范围涵盖了多肽药物、重组蛋白药物、病毒样颗粒(VLP)、质粒DNA、纳米抗体等多种生物药的开发与生产。 此外,耀海生物还提供科研级别的mRNA、CircRNA和SaRNA等前沿技术的定制服务,以满足不断发展的生物科研和制药需求。我们以严格的质量管理体系、先进的实验设施和丰富的行业经验,确保为客户提供高品质的产品和一站式解决方案,助力客户在生物医药领域的创新与发展。 (如需相关CRDMO服务,请随时联系199 5298 1076) 参考文献 [1] David S, Salazar D, Puente Cantillo P, et al. Streamlined E. coli expression and purification of amyloid beta peptides via inclusion body formation and fluorescence monitoring. J Microbiol Methods. 2025 Sep; 236:107182.