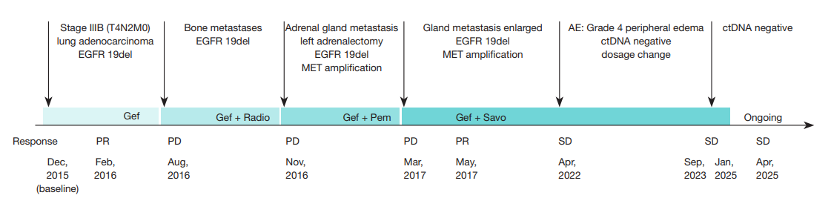
从8个月耐药到8年无进展生存,晚期肺腺癌患者通过 MRD 指导治疗实现长期生存
在肺癌治疗领域,EGFR 靶向药(EGFR-TKI)是无数 EGFR 突变患者的救命药,但耐药始终是绕不开的难题 —— 约 15%-22% 的患者会因MET 扩增出现耐药,以往这类患者的生存期往往受限。
今天病例将介绍一位晚期肺腺癌患者,在MRD(微小残留病灶)监测指导下,通过赛沃替尼(MET 抑制剂)联合吉非替尼(EGFR-TKI)的双靶治疗,不仅有效控制了病情,还实现了超过 8 年的无进展生存(PFS)。
病例回顾:从8个月耐药进展到 8 年无进展生存的逆袭之路
2015 年 10 月,患者因 “咳嗽、咳白痰” 就医,12 月胸部 CT 发现右肺上叶肿块和纵隔淋巴结肿大,最终确诊为IIIB 期肺腺癌(T4N2M0) 。通过下一代测序(NGS)检测,医生发现她携带EGFR 19 号外显子缺失突变(这是 EGFR 靶向药的敏感突变),随即启动一线治疗:吉非替尼(250mg / 天,第一代 EGFR-TKI)。治疗 2 周期后,CT评估显示肿瘤明显缩小,达到部分缓解(PR),疗效显著。
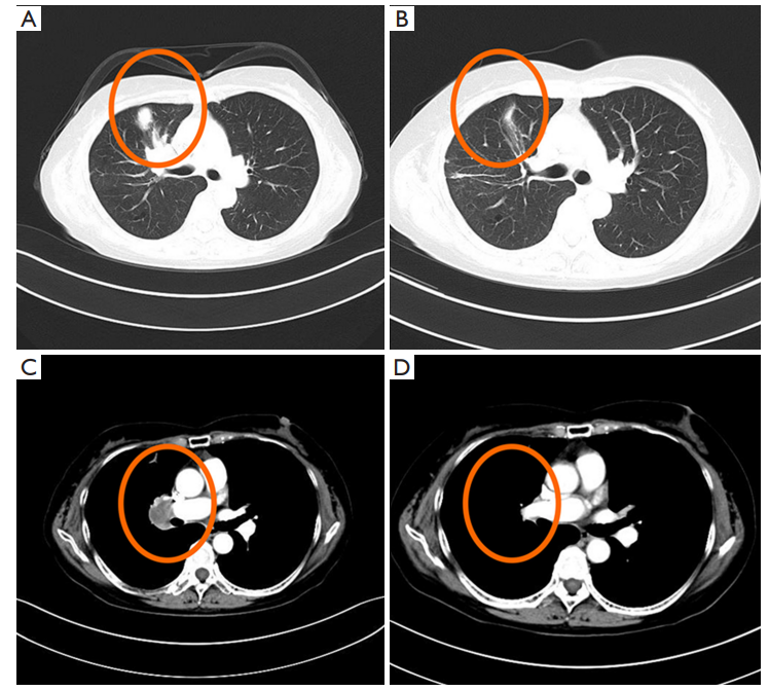
第一代 EGFR-TKI 吉非替尼治疗期间的胸部 CT 图像。(A、C)在开始使用 EGFR-TKI 之前的心肺 CT 检查结果。(B、D)开始使用吉非替尼后的心肺 CT 检查结果。红色圆圈代表肺部肿瘤病灶。
好景维持了 8 个月 ——2016 年 8 月,患者出现头痛,复查发现:
胸部 CT 提示病情进展;
脑部 MRI 显示右侧顶骨溶骨性破坏(骨转移);
进一步检查确认疾病进展至IV 期(T4N2M1) 。
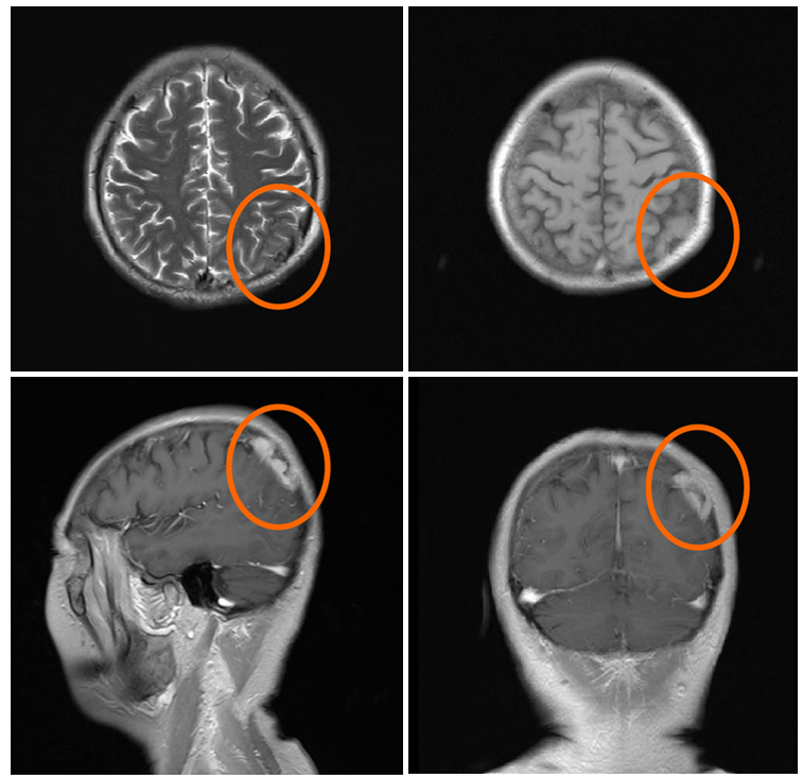
脑部磁共振成像显示吉非替尼治疗后肿瘤的进展情况。红色圆圈所示为溶骨性骨病变
医生先为她进行了骨和胸部放疗(分别为 45Gy/15 次、50Gy/10 次),同时继续服用吉非替尼。但同年 10 月,CT 又发现左侧肾上腺转移(肿瘤进展);11 月患者接受肾上腺切除术,术后病理检测给出关键答案:
荧光原位杂交(FISH)显示MET 扩增(MET/CEP7 比值 = 6.46,远超阳性阈值);
NGS 再次确认 “EGFR 19del+MET 扩增” 双突变,同时无 T790M 突变(另一种常见耐药突变)。
这说明,患者的 EGFR-TKI 耐药,根源是MET 扩增,这是一种旁路激活耐药机制,相当于肿瘤绕开 EGFR 通路,通过 MET 通路继续生长。
2017 年 3 月,患者加入临床研究,开始接受赛沃替尼(600mg / 天,高度选择性 MET 抑制剂)联合吉非替尼(250mg / 天) 治疗。效果立竿见影:CT 评估达到部分缓解(PR),且这个疗效一直维持了超过 60 个月。
长期治疗难免出现不良反应:2022 年初,患者出现 1-2 级外周水肿(MET 抑制剂常见副作用),起初通过 “低盐饮食 + 肢体抬高” 缓解,未调整药量;2022 年 4 月,水肿加重至4 级(严重影响生活),医生没有盲目停药,而是先做了ctDNA 检测(MRD 监测) —— 结果显示 ctDNA 阴性。基于这个关键结果,医生大胆调整方案:将赛沃替尼剂量从 600mg /天减至 400mg / 天,吉非替尼剂量不变。调整后,水肿迅速缓解至 1 级,且后续多次复查(2023 年9 月、2025 年 1 月):
CT 显示肿瘤持续稳定(SD),无进展;
ctDNA 始终阴性;
患者生活质量显著提升,能恢复正常日常活动。
截至 2025 年 4 月,患者的无进展生存(PFS)已超过 8 年。
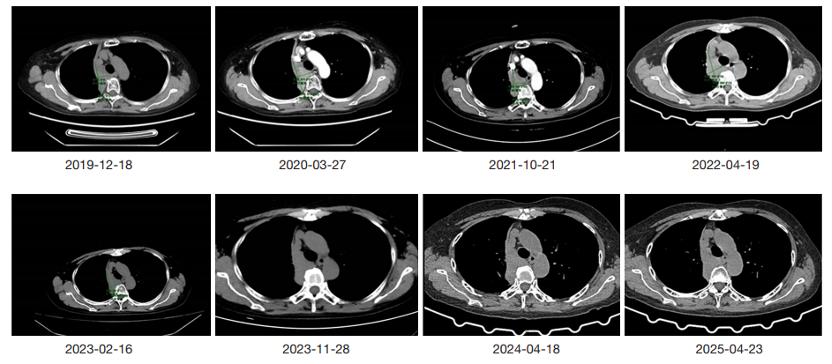
治疗期间的胸部 CT 随访图像。图像中的绿色线条表示肿瘤病灶的测量直径。
在肺癌治疗中,“EGFR+MET 双突变” 患者一直是难啃的骨头,而这个病例的意义,远不止8年无进展生存这一个亮点,更在于它验证了 3 个关键方向:
1. 双靶治疗(EGFR-TKI+MET抑制剂)的长期获益潜力
以往针对 MET 扩增耐药的临床研究,比如 INSIGHT 研究(替泊替尼 + 吉非替尼),双靶治疗的中位 PFS 约 19.3 个月;SACHI研究(赛沃替尼 + 奥希替尼)的 ORR(客观缓解率)为 58%,但长期生存数据有限。而这个病例直接证明:对于部分患者,双靶治疗不仅能快速控瘤,还能实现超过 8 年的长期获益,为这类患者的 “治愈希望” 提供了新证据。
2. MRD是精准调整治疗方案的核心工具
过去,医生调整靶向药剂量多依赖不良反应等级,但可能出现为了减毒牺牲疗效的情况。这个病例则展示了 MRD 的价值:ctDNA 阴性提示患者体内肿瘤负荷极低,疗效已稳定,此时减药可能不会影响控瘤效果。后续减量方案既解决了 4 级水肿的毒性问题,又维持了长期疗效,真正实现疗效与安全的平衡。
事实上MRD 作为重要检测手段,早已被证实能敏感反映体内肿瘤残留情况:比常规 CT 更早发现复发,还能指导治疗强度调整,避免过度治疗或治疗不足。
3. 晚期肺癌也能变成可控慢性病
对于晚期肺癌患者,“长期带瘤生存” 是重要目标。这个病例中,患者从 2015 年确诊晚期,到 2025 年仍保持良好状态,证明:通过 “精准检测(找到双突变)+ 精准治疗(双靶方案)+ 动态监测(MRD 指导调药)”,即使是 EGFR 耐药合并 MET 扩增的难治性肺癌,也能从快速进展的恶性肿瘤转变为长期可控的慢性病,兼顾生存时间与生活质量。
这个突破性病例,也为未来肺癌治疗提供了新的启示:
耐药后必做全面检测:EGFR-TKI 耐药后,不能只查 T790M,还要关注 MET 扩增、HER2扩增等 “旁路耐药机制”—— 只有找到准确的耐药原因,才能选择针对性方案;
MRD 监测应纳入长期管理:对于接受靶向治疗的患者,定期做 ctDNA 检测(MRD),能帮助医生判断疗效、调整剂量,避免盲目停药或加药;
从8个月耐药到 “8 年无进展生存,这个病例不仅是一位患者的幸运,更标志着肺癌精准治疗的又一次进步 —— 当 “分子检测”“双靶药物”“动态监测” 三者结合,晚期肺癌的治疗边界正在不断被打破。
金橡医学实体肿瘤MRD检测产品,组织全外显子锁定监测目标,个体定制化设计监测探针,分癌种特异探针补充,为患者定制个人专属动态监测方案,适用于需要MRD动态监测的实体肿瘤患者。
(案例来源:Liu X, et al. Transl Lung Cancer Res 2025;14 (8):3270-3279. DOI: 10.21037/tlcr-2025-850)