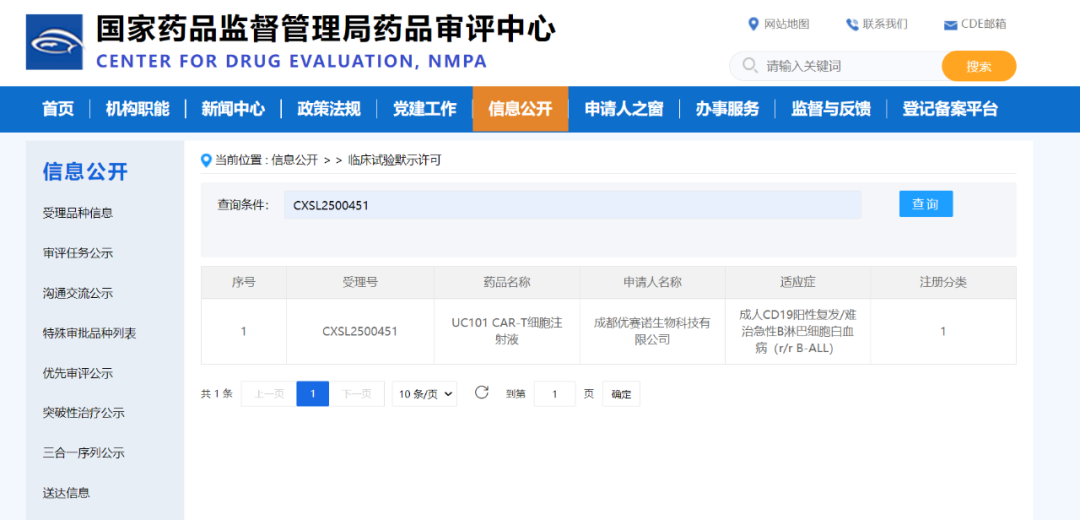
CDE批准!成都优赛诺UC101项目获中国IND批准,全球首个脐血来源异体通用型CAR-T项目获中美审评机构认可
2025年8月22日,成都优赛诺生物科技有限公司(以下简称“成都优赛诺”)宣布,其自主研发的靶向CD19嵌合抗原受体(CAR)异体通用型T细胞注射液(UC101)新药临床试验申请(IND)已获得中国国家药品监督管理局药品审评中心(CDE)正式批准。这是继2025年1月11日该产品获美国食品药品监督管理局(FDA)IND批准后,在全球监管进程中的又一里程碑,标志着这款具有全球首创性的脐血来源异体通用型CAR-T药物获得中美两国审评机构的认可,为急性B淋巴白血病(B-ALL)及其他适应症患者带来突破性治疗希望。
一、技术创新:脐血来源与基因编辑的双重突破
UC101以新生儿脐血为起始原材料,通过多基因编辑技术实现异体通用型设计,攻克了传统CAR-T治疗的核心瓶颈:
1.免疫原性调控:脐血T细胞天然低免疫原性,结合CRISPR/Cas9基因编辑技术敲除T细胞受体(TCR)及主要组织相容性复合体(MHC)基因,从源头消除移植物抗宿主病(GvHD)和宿主抗移植物反应(HvGR)风险。
2.细胞活性优势:脐血中90%为初始T细胞,经体外扩增后仍保留80%的记忆干性T细胞(Tscm)和中心记忆T细胞(Tcm),其体内扩增能力和持久性显著优于传统CAR-T细胞,可实现更持久的治疗效果。
3.生产工艺革新:全球首创采用稳转细胞系生产慢病毒载体,无需质粒原料,工艺简洁且成本降低70%以上,单批次生产可满足100人份以上需求,大幅提升药物可及性。
二、临床价值:从血液肿瘤到自免疾病的广泛潜力
UC101的核心适应症为急性B淋巴白血病,其早期研究者发起的临床研究(IIT)已展现显著疗效:
1.血液肿瘤领域:在急性B淋巴白血病患者中,UC101的完全缓解率高达90%,且不良反应可控,关键指标优于国际同类产品。
2.适应症拓展:基于其独特的B细胞清除能力,UC101计划在身免疫性疾病中开展探索性研究。
三、国际化进程:中美双报验证全球竞争力
UC101的中美IND获批具有多重战略意义:
1.FDA认可的里程碑:2025年1月FDA的批准,不仅是全球首个脐血来源异体通用型CAR-T的监管突破,更验证了成都优赛诺在基因编辑、生产工艺和质量控制方面的国际领先水平。
2.CDE批准的本土价值:此次CDE批准标志着中国在通用型CAR-T领域的自主创新能力获得权威认可,为后续适应症拓展和商业化铺平道路。
四、产业协同:全链条生态助力技术转化
UC101的研发得到国内生物医药产业链的深度支持:
1.CDMO合作伙伴:诸多合作伙伴在开发过程中给予了大力的支持,诸如:深研生物提供了稳转细胞株的构建筛选工作,和元生物提供GMP级别生产辅助细胞生产服务,云舟生物提供临床级慢病毒载体生产服务,金斯瑞的eSpCas9基因编辑工具保障了基因敲除的精准性,珠海舒桐提供脱靶检测,等等。
2.生产平台支撑:依托成都天府国际生物城的BIO-LINK生物医药孵化器和国际平行试验室,UC101在工艺开发和质量研究阶段显著降低成本,加速了从实验室到临床的转化。
五、公司战略:推动细胞治疗从“定制”到“通用”的跨越
“UC101的中美双报获批,是成都优赛诺‘全球化、通用化、普惠化’战略的重要落地。”公司创始人邹强教授表示,“我们将以急性B淋巴白血病为起点,逐步拓展至多发性骨髓瘤、系统性红斑狼疮等适应症,同时探索脐血来源CAR-T在实体瘤中的应用潜力。未来,我们希望通过技术创新和工艺优化,将CAR-T治疗成本降低至10万元人民币以内,让更多患者受益于这一革命性疗法。”
UC101项目IND获得中美审评机构的批准,说明优赛诺异体通用型CAR-T细胞开发技术平台得到了的认可,这就意味着采用该技术平台能够开发出更多免疫兼容的同种异体细胞治疗药物,这一突破不仅为急性B淋巴白血病患者带来新希望,更标志着中国在全球细胞治疗领域从“跟跑”向“领跑”的转变,为世界上千千万万的患者及家属带来希望。