FcRH5靶点:多发性骨髓瘤治疗的新希望
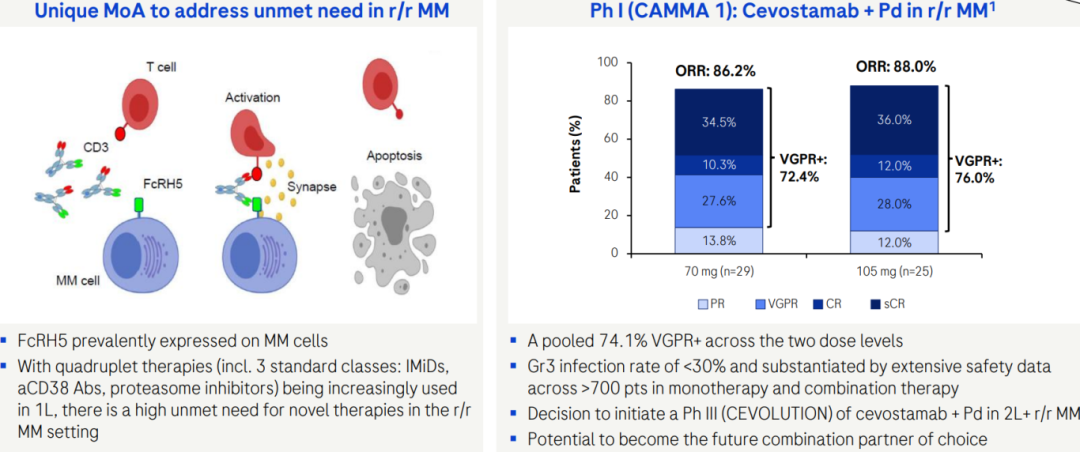
2025年9月22日,Roche在2025年度Pharma Day活动上宣布FcRH5×CD3双抗Cevostamab进入3期临床试验(CEVOLUTION),预计将于2026年启动,旨在评估Cevostamab联合Pd(泊马度胺和地塞米松)用于治疗二线及以上复发/难治性多发性骨髓瘤(2L+r/r MM)患者中的疗效。Roche在该活动上也重点披露了1期CAMMA1数据,Cevostamab两种剂量水平(70mg和105mg)的ORR分别达到86.2%和88%。此外,单药和联合治疗,3级感染率均低于30%,显示出良好的安全性。Roche认为Cevostamab有潜力成为未来该治疗领域的首选联合治疗伙伴。
多发性骨髓瘤(Multiple Myeloma, MM)是一种起源于骨髓中浆细胞的血液系统恶性肿瘤,其发病机制是骨髓浆细胞发生恶变异常增殖,导致单克隆免疫球蛋白的过度产生,从而引发骨骼病变、肾功能衰竭、贫血和高钙血症等临床并发症[1]。在过去的几十年中,诸如蛋白酶体抑制剂、免疫调节剂和单克隆抗体等新型药物已显著提高了MM患者的缓解率和总生存期。目前,MM患者的中位总生存期为5年。低风险的I期患者有82%能够存活5年,但大多数I期患者最终会产生耐药性,对治疗产生抵抗,并转变为高风险患者;而高风险的III期患者仅有40%能够存活5年,III期患者通常会对初始治疗无反应或容易早期复发[2][3]。由此可见,MM的复发是不可避免的结果,这表明目前治疗MM的首要策略是探索新的靶点,以延长多发性骨髓瘤患者的生存期[4]。
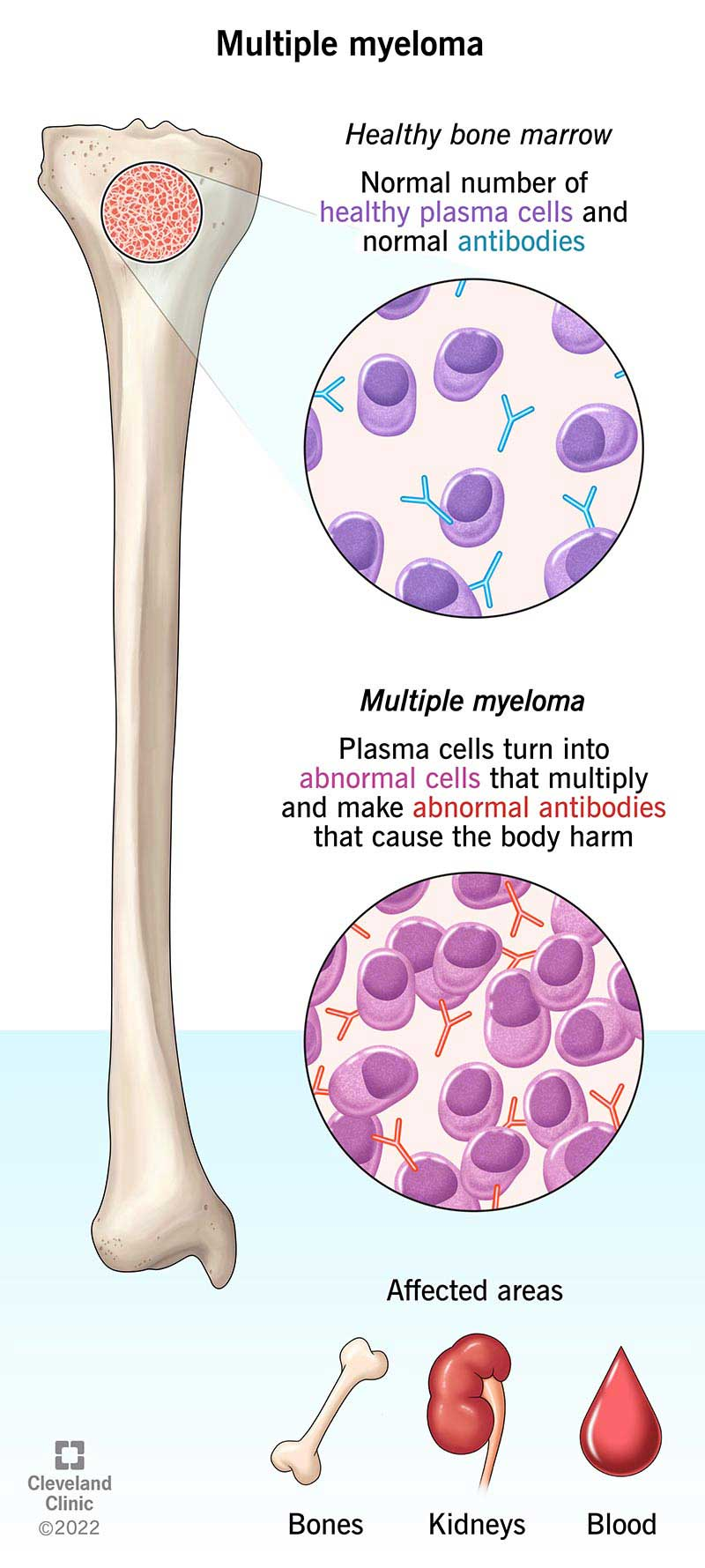
多发性骨髓瘤示意图[5]
FcRH5,又称为FcRL5、IRTA2或CD307,其基因位于1q21染色体断裂点。FcRH5仅在B细胞谱系中表达,从B细胞发育的前B细胞阶段开始出现,并且随着B细胞的逐步成熟,其表达水平呈现出逐渐上升的趋势,这一过程一直持续到B细胞发育为初始B细胞以及进一步分化为浆细胞[6]。
FcRH5是属于免疫球蛋白超家族(IgSF)的I型跨膜糖蛋白,编码977个氨基酸,其胞外段包含9个lg样结构域,胞内含有1个免疫受体酪氨酸激活基序(ITAM)和2个抑制基序(ITIM)[7],在调节B细胞活性中发挥双重作用,既能激活也能抑制免疫反应。当FcRH5与B细胞抗原受体(BCR)交联时,它可以通过其ITIM招募SHP-1(蛋白酪氨酸磷酸酶),降低酪氨酸磷酸化水平,防止免疫过度;相反,FcRH5也可以促进B细胞的激活和分化。与BCR共刺激后,FcRH5可以增强初始B细胞的增殖和分化,该激活功能与Lyn(Src家族激酶)招募到FcRH5的ITAM有关。激活和抑制信号之间的平衡,由SHP-1和Lyn等分子介导,决定了B细胞激活的结果,并有助于维持免疫稳态。而当FcRH5表达失控后,它可能会促成B细胞恶性肿瘤的发生[8]。研究发现,FcRH5在MM患者浆细胞中的表达水平显著高于正常B细胞[4]。流式细胞术分析显示,在MM患者的骨髓浆细胞样本中,FcRH5的表达比GPRC5D和BCMA更为普遍[9],FcRH5因此被鉴定为治疗MM的又一个潜力靶点。
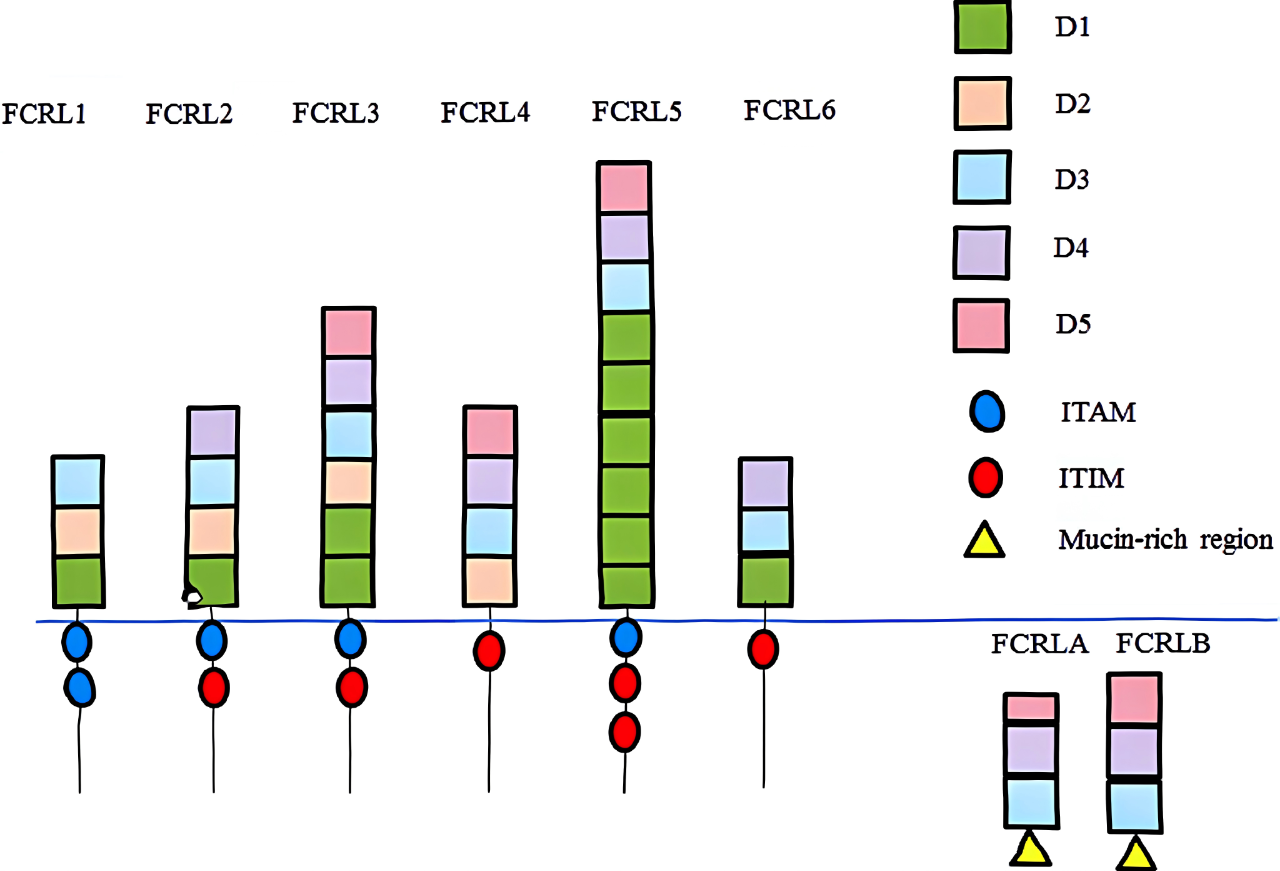
FcRH蛋白结构[7]
FcRH5基因有三种不同的mRNA亚型(FcRH5a、FcRH5b和FcRH5c),FcRH5c即为前文所述的跨膜蛋白;FcRH5a是一种分泌型蛋白,含有8个Ig样结构域,C端有13个独特的极性的氨基酸;FcRH5b是一种糖鞘磷脂酰肌醇(GPI)锚定的膜蛋白,其前6个Ig样结构域后面接了一个含有GPI附着信号的肽段(32个氨基酸)。基于三种不同亚型的结构特征,Ig样结构域9成为FcRH5独特的胞外域[10]。此外,研究表明,在MM患者的恶性浆细胞中,会分泌大量的可溶性FcRH5a,进一步提示治疗性抗体应特异性靶向跨膜形式FcRH5c的lg样结构域9。
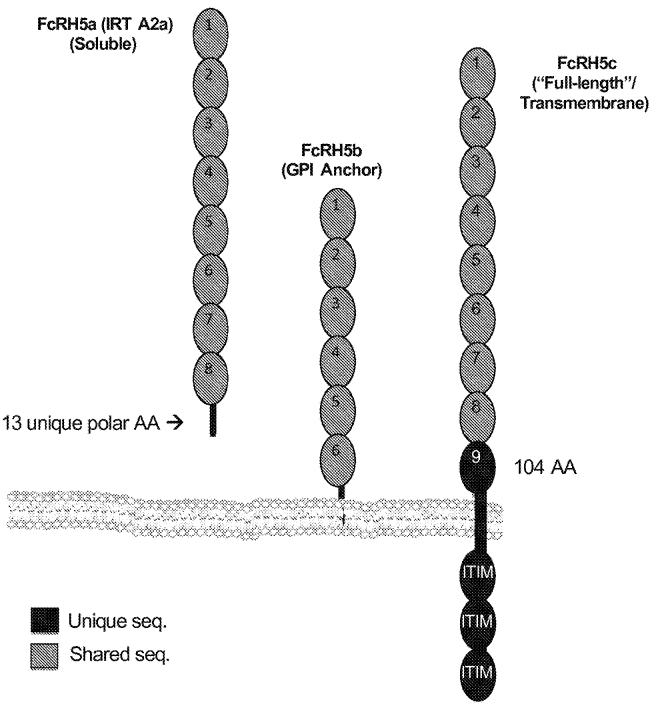
FcRH5的三种不同亚型[10]
RG-7598(DFRF4539A)的临床被迫终止也证实了靶向lg样结构域9的重要性,该药物是由Genentech开发的一款靶向FcRH5的ADC药物,曾进入过临床I期,在异种移植模型中表现出显著的疗效,但临床结果显示患者的缓解率普遍较低。DFRF4539A失败的原因之一即为多发性骨髓瘤患者血液中可溶性FcRH5a水平的升高,可能导致DFRF4539A与跨膜型FcRH5c的结合减少,从而影响药物的作用效果[11]。该药物的临床失败为后续FcRH5药物的表位设计提供了重要启示。
目前,靶向FcRH5的药物类型主要集中在T细胞依赖的双特异性抗体(T cell-dependent bispecific antibody, TDB)、ADC和CAR-T。进展最快的当属前文提及的Cevostamab(BFCR4350A),它是一款TDB药物,靶向骨髓瘤细胞上的FcRH5近膜结构域和T细胞上的CD3。在抗体开发过程中,研究人员设计了三款靶向FcRH5不同区域(近膜区域、中心区域和远端区域)的TDB(如下图),研究结果显示,近膜域的表位对于抗FcRH5×CD3 TDB形成有效的免疫突触以及发挥杀伤作用是必需的[1]。一项初步临床活性和安全性的试验结果显示,Cevostamab单药治疗在大量接受过预治疗的复发/难治性多发性骨髓瘤(R/R MM)患者中显示出潜在的疗效[4]。
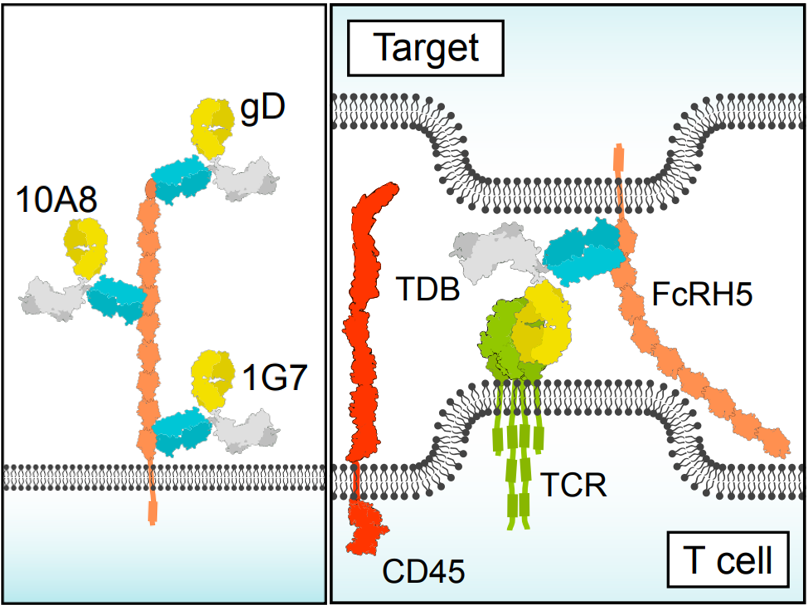
Cevostamab识别FcRH5近膜结构域[1]

部分FcRH5靶向药物
FcRH5作为一个极具潜力的MM治疗靶点,为MM的治疗提供了更多的选择性和可能性。恺佧生物供应高品质的FcRH5和FcRH5近膜域Domain蛋白,覆盖多个种属和多种标签设计。在抗体开发过程中,除了可采用FcRH5全长胞外区外,也可以采用近膜域Domain蛋白进行免疫、筛选,以得到更具杀伤力的抗体。
数据示例:
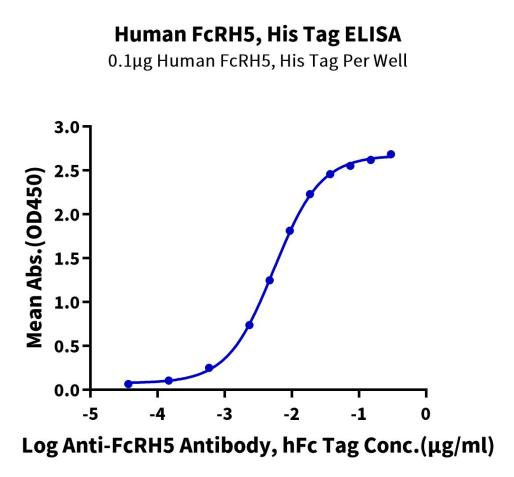
Immobilized Human FcRH5, His Tag at 1 μg/ml (100 μl/well) on the plate. Dose response curve for Anti-FcRH5 Antibody, hFc Tag with the EC50 of 5.4 ng/ml determined by ELISA (QC Test).
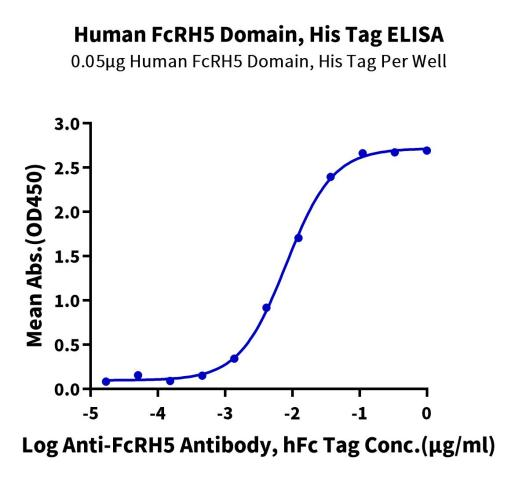
Immobilized Human FcRH5 Domain, His Tag at 0.5 μg/ml (100 μl/well) on the plate. Dose response curve for Anti-FcRH5 Antibody, hFc Tag with the EC50 of 8.1 ng/ml determined by ELISA (QC Test).
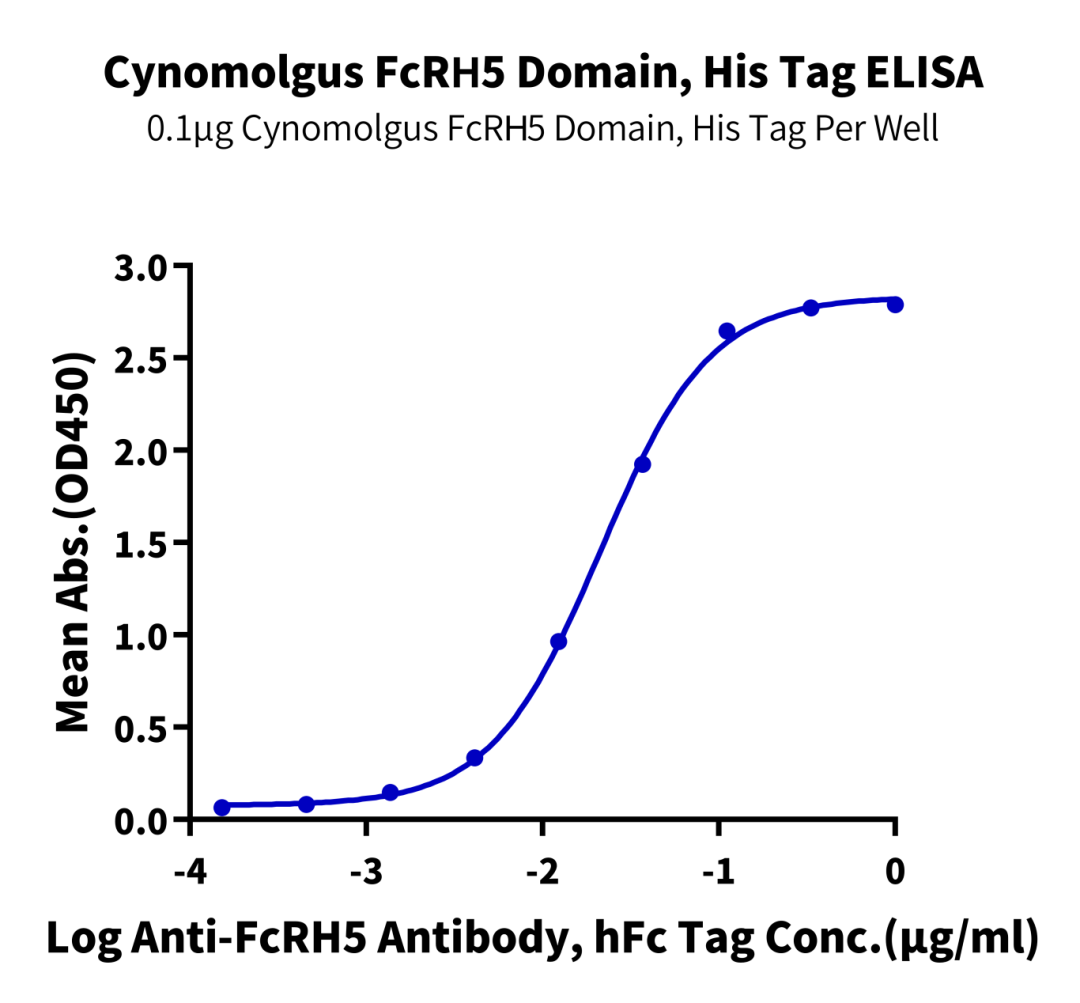
Immobilized Cynomolgus FcRH5 Domain, His Tag at 1 μg/ml (100 μl/well) on the plate. Dose response curve for Anti-FcRH5 Antibody, hFc Tag with the EC50 of 21.3 ng/ml determined by ELISA (QC Test).
产品列表:
FCR-HM10D | Human FcRH5 Domain Protein | ||
FCR-HM20D | Human FcRH5 Domain Protein | ||
参考资料:
[1] Li, Ji et al. “Membrane-Proximal Epitope Facilitates Efficient T Cell Synapse Formation by Anti-FcRH5/CD3 and Is a Requirement for Myeloma Cell Killing.” Cancer cell vol. 31,3 (2017): 383-395. doi:10.1016/j.ccell.2017.02.001
[2] Palumbo A, Avet-Loiseau H, Oliva S, Lokhorst HM, Goldschmidt H, Rosinol L, et al. Revised international staging system for multiple myeloma: a report from international myeloma working group. J Clin Oncol. (2015) 33:2863-9. doi: 10.1200/JCO.2015.61.2267
[3] Avet-Loiseau H. Ultra high-risk myeloma. Hematol Am Soc Hematol Educ Program. (2010) 2010:489–93. doi: 10.1182/asheducation-2010.1.489
[4] Cheng, Linyan et al. “Efficacy and safety of bispecific antibodies vs. immune checkpoint blockade combination therapy in cancer: a real-world comparison.” Molecular cancer vol. 23,1 77. 16 Apr. 2024, doi:10.1186/s12943-024-01956-6
[5] Multiple Myeloma: Signs and symptoms, Causes, Stages, Types, Diagnosis and Treatment options - Page 4 of 6 - TheLifeToday
[6] Polson AG, Zheng B, Elkins K, Chang W, Du C, Dowd P, et al. Expression pattern of the human FcRH/IRTA receptors in normal tissue and in B-chronic lympho cytic leukemia. Int Immunol. 2006;18:1363–73.
[7] Capone, Mollie et al. “Fc Receptor-Like Proteins in Pathophysiology of B-cell Disorder.” Journal of clinical & cellular immunology vol. 7,3 (2016): 427. doi:10.4172/2155-9899.1000427
[8] What Is FcRH5? Role in Immunity, Disease, and Treatment - Biology Insights
[9] Devasia, A.J., Chari, A. & Lancman, G. Bispecific antibodies in the treatment of multiple myeloma. Blood Cancer J. 14, 158 (2024). https://doi.org/10.1038/s41408-024-01139-y
[10] US 10,435,471 B2
[11] Stewart, A.K., Krishnan, A.Y., Singhal, S. et al. Phase I study of the anti-FcRH5 antibody-drug conjugate DFRF4539A in relapsed or refractory multiple myeloma. Blood Cancer Journal 9, 17 (2019). https://doi.org/10.1038/s41408-019-0178-

