【注册临床 | 首例给药】士泽生物联合北医三院完成iPSC再生神经细胞治疗渐冻症受试者给药
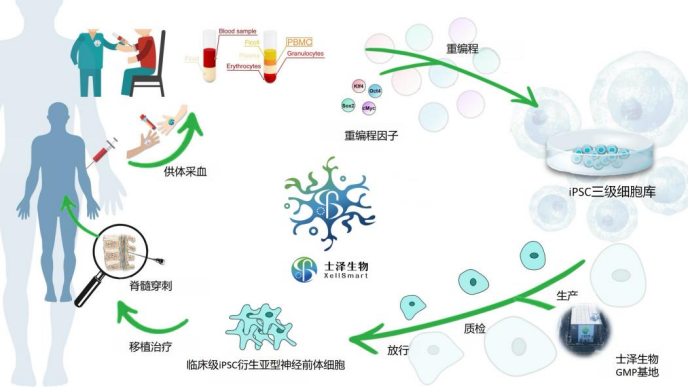
2025年9月,“全球首个”中美药监局双报双批注册临床试验——iPSC衍生亚型神经前体细胞新药治疗“全球五大绝症之一”渐冻症(肌萎缩侧索硬化症)注册临床I/II期试验,在北京大学第三医院正式启动并顺利完成首例受试者给药,本项注册临床试验采用士泽生物医药(苏州)有限公司自主研发的“全球首款(FIC)”异体通用“现货型”iPSC再生亚型神经前体细胞新药( “XS228细胞注射液”)。
通过腰穿注射,首例受试者接受临床级通用型iPSC衍生亚型神经前体细胞新药(XS228细胞注射液)治疗,未发生手术及围术期的并发症或其他不良事件,各项检测指标正常,平稳度过观察期并进入随访期。
渐冻症是一种运动神经元病及进行性神经退行性疾病,渐冻症患者俗称渐冻人。渐冻症患者的运动神经元持续退行性病变和死亡,导致患者出现上、下运动神经元合并受损,最终可导致瘫痪,从无法行走到无法说话、吞咽、呼吸。临床数据显示,渐冻症患者的平均存活期约39个月,目前尚无能够实质性缓解或挽救渐冻症的有效临床药物及临床解决方案,迫切需要开发新的治疗方案。
士泽生物自主研发的“全球首款”临床级异体通用“现货型”iPSC衍生亚型神经前体细胞新药(XS228细胞注射液)治疗渐冻症:
成为首个中国自主iPSC衍生细胞药获得FDA认证并授予孤儿药资格(Orphan Drug Designation),也是全球首个且迄今唯一用于治疗渐冻症的拥有孤儿药资格的iPS衍生细胞药物。
根据美国《Orphan Drug Act》,获得美国孤儿药资格认定的药物可以享受新药获批上市后7年市场独占权(marketing exclusivity)、免除NDA/BLA申请费、可能免除部分临床数据的申报要求以及临床研究费用税收减免等一系列加速审评及特别扶持政策。
北京大学第三医院作为本项注册临床试验的牵头临床中心,由渐冻症诊疗领域顶级专家樊东升主任作为牵头中心临床负责人。
士泽生物专注于开发临床级、异体通用、“现货型”iPSC衍生细胞药用于治疗神经系统疾病(CNS Diseases):士泽生物已获得中国国家药监局(NMPA)和美国食品药品监督管理局(U.S.FDA)正式批准的七项中美注册临床试验批件,多款通用型iPSC衍生神经细胞新药已处于中美注册临床试验阶段,包括用于治疗:
全球第二大神经退行性疾病原发性帕金森病(中美注册临床I期);
早发性帕金森病(中国注册临床I/II期);
重大神经系统疾病脊髓损伤(中美注册临床I期);
肌萎缩侧索硬化症/渐冻症(中国注册临床I/II期及美国注册临床I期,美国FDA认证并授予全球孤儿药资格)。
士泽生物自主开发的异体通用型iPSC衍生细胞治疗帕金森病、脊髓损伤及渐冻症的重要研发及临床进展,代表我国在开发临床级iPSC衍生细胞新药治疗以帕金森病及渐冻症为代表的神经系统疾病方向处于全球同步领先或全球首创地位。
士泽生物已开展的人体临床研究的积极结果,为后续进一步开展临床试验提供了重要的铺垫和关键的验证。期待士泽生物在重要的研发及临床进展基础上,强强联合顶级医院及顶级临床专家的中国团队开展多项注册临床试验,在开发临床级iPSC衍生亚型神经细胞新药治疗以帕金森病、脊髓损伤及渐冻症代表的神经退行病中做出更多创新和贡献,给更多患者带来帮助和福音!
士泽生物-北京大学第三医院-注册临床试验I/II期招幕-临床级iPSCs再生神经细胞治疗渐冻症
入组标准包括但不限于:
1. 年龄18-75岁(包含18岁和75岁),性别不限;
2. 依据修订的EI Escorial诊断标准,结合临床表现等诊断为确诊、很可能、实验室支持的很可能肌萎缩侧索硬化症,从首次症状出现至筛选时病程不超过2年;
3. 筛选期/基线期参与者呼吸功能用力肺活量(FVC%)≥70%预计值;
排除标准包括但不限于:(符合以下任一条标准的对象将排除于本研究)
1. 患者具有神经肌肉无力的症状和体征,不能排除其他原因引起的肌肉无力;
2. 患者体重指数BMI<18.5kg/m2;
3. 患者仅表现为上运动神经元症状的原发性侧索硬化症;
4. 患有神经或肌肉功能损害的疾病,如代谢性肌肉疾病、重症肌无力;
5. 诊断自身免疫性疾病且病情未控制的、严重的关节炎、跛行等疾病,研究者评估影响评价的;
6. 有气管切开手术史,或使用机械辅助通气者;
7. 控制不佳的高血压,收缩压>160 mmHg和/或舒张压>100 mmHg;
您将获得交通补贴和相关补助。
咨询热线:
17317916592
(请说明“士泽生物再生神经细胞治疗渐冻症临床试验报名咨询”)
扫码报名


士泽生物由创始人李翔博士于2021年全职归国创立。士泽生物专注于开发临床级、异体通用、“现货型”iPSC衍生细胞药用于治疗神经系统疾病(CNS Diseases):
士泽生物已获得中国国家药监局(NMPA)和美国食品药品监督管理局(U.S.FDA)正式批准的七项中美注册临床试验批件,多款通用型iPSC衍生神经细胞新药已处于中美注册临床试验阶段,包括用于治疗:
全球第二大神经退行性疾病原发性帕金森病(中美注册临床I期);
早发性帕金森病(中国注册临床I/II期);
重大神经系统疾病脊髓损伤(全球首款新药;中美注册临床I期);
肌萎缩侧索硬化症/渐冻症(全球首款新药及全球孤儿药;中国注册临床I/II期及美国注册临床I期),为中国首个自主iPSC衍生细胞药获美国FDA认证并授予全球孤儿药资格。
士泽生物为江苏省双创团队领军企业,姑苏重大创新团队企业、姑苏创新创业领军人才企业、上海市东方英才计划企业、上海市春申计划杰出引进人才企业等;连续获评中国潜在独角兽及江苏省潜在独角兽企业;连续两年获得国家科技部全国颠覆性技术创新大赛优胜奖(最高奖)等;获我国《科技日报》《新华日报》《光明日报》《科创板日报》等多次报道。
士泽生物2021-25连续五年完成多轮数亿元纯市场化融资:由峰瑞资本、启明创投、礼来亚洲基金、红杉中国、泰珑/泰鲲资本等多家顶级风险投资机构领投及多轮持续投资。


