2025诺贝尔奖聚焦Treg细胞:靶向治疗新策略与小鼠模型应用
2025年10月6日,瑞典卡罗琳医学院宣布将本年度诺贝尔生理学或医学奖授予美国科学家玛丽·E·布伦科(Mary E. Brunkow)、弗雷德·拉姆斯德尔(Fred Ramsdell)及日本科学家坂口志文(Shimon Sakaguchi),以表彰他们在外周免疫耐受机制研究中所做出的开创性贡献。这一系列里程碑式的发现不仅系统阐释了免疫系统“自我约束”的核心生物学机制,还通过小鼠模型与临床实验的紧密结合,为自身免疫性疾病、癌症免疫治疗及器官移植等多个重大医学领域提供了突破性的治疗策略与理论基石。

图1.三位获奖者[来源于网络]
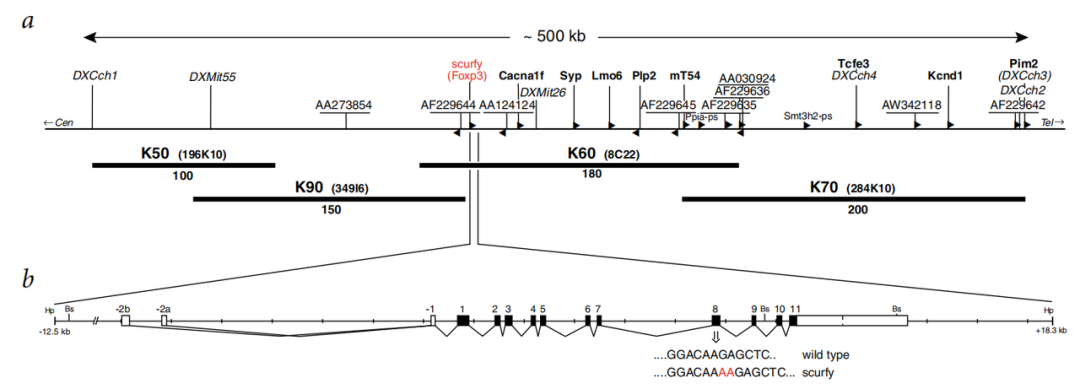
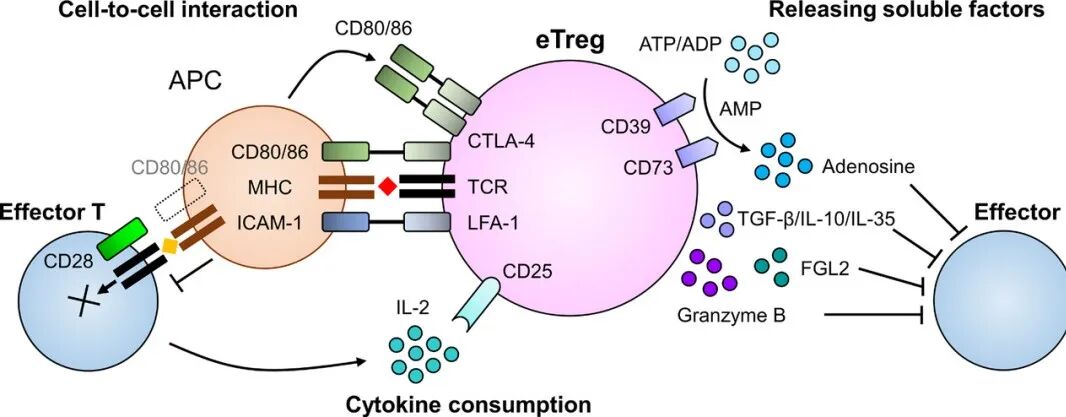
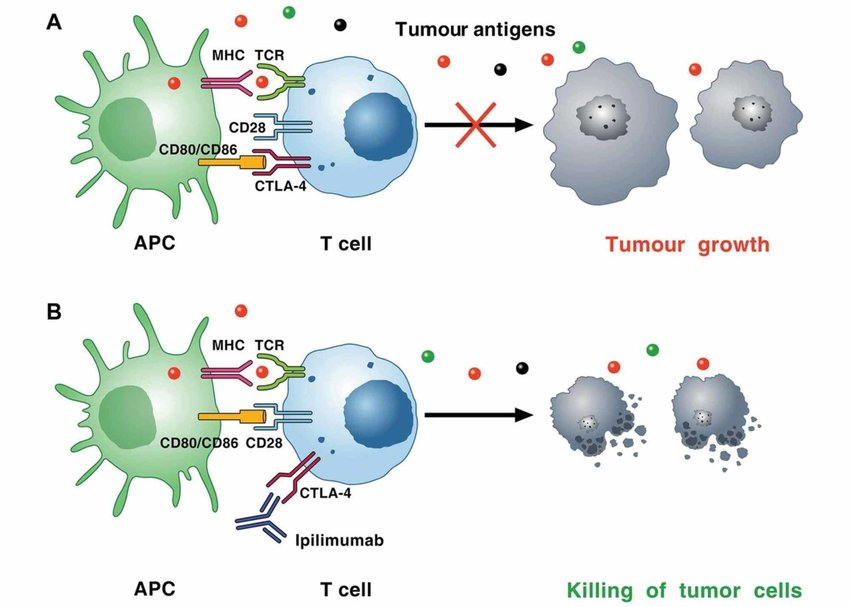
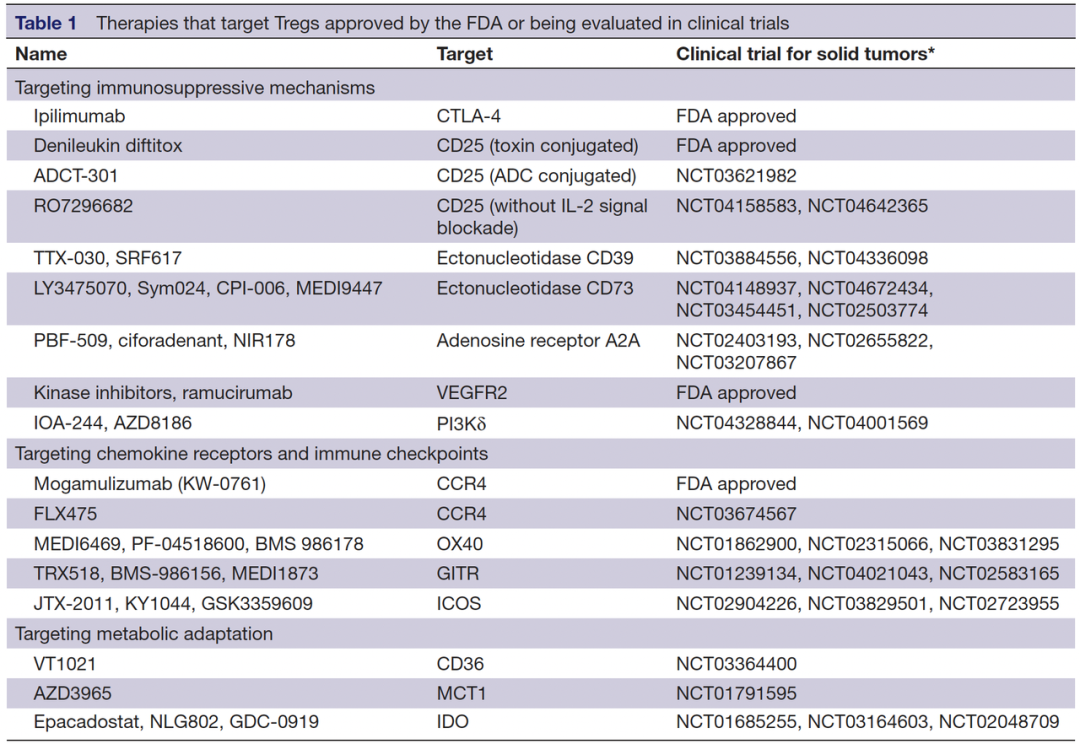
外周免疫耐受理论的奠基: 从Treg细胞鉴定到Foxp3基因发现 外周免疫耐受机制的揭示始于三项具有连续性和互补性的重大科学突破。1995年,坂口志文团队在《The Journal of Immunology》上发表的研究中首次识别出CD4⁺、CD25⁺调节性T细胞(Regulatory T cells, Treg)这一功能明确的细胞亚群,并证实其可通过主动抑制效应T细胞的活性以维持外周免疫平衡。这项工作从根本上颠覆了“免疫耐受仅依赖中枢胸腺选择”的传统理论框架,为后续研究奠定了坚实基础[1]。 图2.CD4⁺、CD25⁺Treg亚群鉴定 2001年,布伦科与拉姆斯德尔在研究scurfy小鼠(一种自身免疫突变模型)时发现,X染色体上编码Foxp3的基因发生突变会导致严重的系统性免疫失调,其表型包括多内分泌腺病、肠病及自身抗体水平异常升高,与人类IPEX综合征(免疫失调、多内分泌腺病、肠病、X连锁综合征)高度一致。该研究首次建立了Foxp3基因与免疫耐受缺陷之间的因果关系,论文发表于《Nature Genetics》[2]。 坂口志文团队随后通过一系列谱系追踪与功能验证实验进一步证明,Foxp3不仅是Treg细胞的标志性分子,更是其发育与功能执行的“主控转录因子”,直接调控CTLA-4、TGF-β等抑制性分子的表达。这些发现标志着Tcell调控机制的研究从现象描述阶段进入分子机制解析阶段[3]。 图4. “Treg-Foxp3-免疫耐受”调控轴 1995年:坂口志文鉴定CD4⁺CD25⁺Treg细胞,提出外周免疫耐受新机制; 2001年:布伦科与拉姆斯德尔发现Foxp3基因突变与 scurfy 小鼠及人类IPEX综合征的因果关系; 2003年:坂口团队证实Foxp3是Treg细胞分化和功能的主控因子,确立“Treg–Foxp3–免疫耐受”调控轴。 Treg细胞的临床双向价值: 从自身免疫性疾病到癌症治疗 三位科学家的系统性研究揭示了调节性T细胞在免疫稳态中的双重作用:在生理条件下,Treg细胞通过主动抑制过度免疫反应,有效防止自身组织遭受攻击;而在病理状态下,其功能异常或可塑性失衡则直接参与多种疾病的发生与发展。在自身免疫性疾病中,Treg细胞的功能缺陷或数量下降被认为是类风湿关节炎等自免性疾病发生的重要机制之一。例如,IPEX综合征患者因Foxp3基因突变导致Treg细胞功能丧失,临床表现为多器官自身免疫损伤,这提示通过过继性输注功能性Treg细胞或增强内源性Treg活性,可能成为治疗自身免疫疾病的潜在策略。 与之相反,在肿瘤微环境中,Treg细胞通过高表达CTLA-4、PD-1等免疫检查点分子,并分泌IL-10、TGF-β等抑制性细胞因子,共同构建局部“免疫抑制屏障”,促进肿瘤免疫逃逸。临床观察数据显示,胶质母细胞瘤患者肿瘤浸润淋巴细胞中Treg比例每增加10%,其中位生存期缩短3.2个月[5];在非小细胞肺癌中,Treg频率与肿瘤细胞PD-L1表达呈正相关,且为独立预后不良因素[6]。因此,特异性靶向肿瘤相关Treg细胞(如使用抗CTLA-4抗体以清除或功能抑制Treg)已成为打破免疫抑制状态、增强抗肿瘤应答的重要治疗方向。目前全球范围内已有超过200项靶向Treg的疗法进入Ⅱ/Ⅲ期临床研究阶段。 Treg细胞的生物学特性与免疫调节机制 调节性T细胞(Treg)是CD4⁺T细胞的关键亚群,核心功能为维持免疫稳态,通过抑制过度免疫反应调控自身耐受、肿瘤免疫及炎症平衡等生理过程,其生物学特性与功能机制的解析为靶向治疗提供了核心理论基础。 FOXP3是Treg细胞的标志性转录因子,对其发育与功能至关重要,较CD4、CD25等表面标志物更具特异性。该基因功能缺失将导致免疫系统失控:人类FOXP3突变引发X连锁自身免疫-过敏失调综合征(IPEX),表现为严重自身免疫性肠病、内分泌紊乱及过敏反应;小鼠Foxp3突变得到的scurfy模型,出现全身性淋巴细胞增殖与多器官炎症,这一现象证实Foxp3是Treg抑制功能的'分子开关'[2]。 图5. Foxp3基因突变[2] 1. 天然调节性T细胞(nTregs):在胸腺中经TCR与自身抗原-MHC复合物高亲和力相互作用发育成熟,主要通过细胞间直接接触维持中枢免疫耐受,控制自身反应性T细胞活化。 2. 诱导调节性T细胞(iTregs):由外周初始CD4⁺T细胞在肿瘤微环境等特定条件下,经TGF-β、IL-2等信号诱导分化而成,富集于肿瘤组织,通过抑制效应T细胞(Teff)、NK细胞及树突状细胞(DC)的抗肿瘤活性促进免疫逃逸。 Treg细胞通过以下途径实现免疫抑制,其分子机制的多样性使其成为免疫稳态调控的关键节点: 1. 细胞因子竞争性抑制:Treg高表达CD25(IL-2受体α链),可高效摄取微环境中的IL-2,导致效应T细胞因细胞因子饥饿而增殖受限。 2. 代谢干扰机制:通过CD39和CD73介导的腺苷生成途径,Treg将细胞外ATP转化为腺苷,后者通过A2A/A2B受体信号通路抑制Teff细胞的活化和功能。 3. 抑制性细胞因子分泌:Treg分泌的TGF-β、IL-10及IL-35等可直接抑制效应T细胞和抗原呈递细胞的功能,例如下调细胞毒性分子表达或抑制NF-κB通路活化。 4. 免疫检查点介导的调节:CTLA-4组成性表达于Treg表面,通过与CD80/CD86高亲和力结合,阻断CD28共刺激信号,并诱导IDO表达,进一步抑制局部T细胞应答。 5. 细胞毒作用:部分活化的Treg可分泌颗粒酶(granzyme)和穿孔素(perforin),直接杀伤自身反应性T细胞,从而控制过度免疫活化。 综上,Treg细胞通过精准的身份调控(Foxp3依赖性)与复杂的多维度抑制网络,成为维持免疫平衡的核心枢纽。其亚群特异性功能与机制多样性为靶向治疗(如肿瘤免疫治疗中选择性耗竭iTregs)提供了关键理论依据。 Treg细胞关键治疗靶点与靶向策略进展 Treg细胞通过诱导免疫无能和免疫抑制促进肿瘤逃逸,其靶向清除或功能调控已成为增强抗肿瘤免疫的核心策略,当前Treg靶向治疗已形成'经典靶点优化—新兴靶点突破'的发展格局。 CTLA-4作为最早被验证的Treg相关免疫检查点,其抗体在小鼠模型中通过抗体依赖细胞介导的细胞毒性(ADCC)特异性清除肿瘤浸润Treg,从而解除免疫抑制。然而在临床研究中,Ipilimumab等CTLA-4抗体的疗效与外周血Treg消耗无显著相关性,提示其作用机制可能涉及效应T细胞共刺激信号调节等非Treg依赖途径。正在进行的NCT04158583临床试验通过动态监测肿瘤微环境中Treg比例变化[11],有望为这一争议提供新证据。 CD25作为Treg表面最成熟的靶点,已有多种药物进入临床评估。其中ADC药物Camidanlumab tesirine(Cami/ADCT-301),在117例复发/难治性霍奇金淋巴瘤患者中,其ORR达70.1%,CR率33.3%,中位缓解持续时间(mDOR)13.7个月[8]。此外,新的CD25靶向药物的研究趋势正从“广泛清除”转向“精准调控”,去岩藻糖基化的抗CD25抗体RG6292可特异性增强对Treg的清除能力,同时保留效应T细胞的IL-2信号通路,目前已进入II期临床试验[9]。 CCR8作为肿瘤浸润Treg高度特异性表达的趋化因子受体,成为近期热门靶点。礼新医药开发的LM-108(抗CCR8单抗)在2025年ASCO年会上公布的数据显示,与PD-1抑制剂联用在晚期胃癌患者CCR8高表达亚组中客观缓解率(ORR)达到87.5%[4]。另一新兴靶点RBPJ作为iTreg分化的负向调控因子,其小分子抑制剂目前尚处于临床前阶段,初步研究显示敲除 RBPJ 可增强 iTreg(诱导型Treg细胞)的稳定性和功能[7]。 尽管Treg靶向治疗取得显著进展,仍面临靶点特异性不足、肿瘤微环境异质性及自身免疫副作用等挑战。未来研究需进一步开发双特异性抗体、条件性基因编辑系统及亚型选择性调控手段,以提升治疗指数与安全性。 Treg细胞研究中的小鼠模型应用 在Treg细胞的靶向治疗研究过程中,实验动物模型,尤其是基因工程小鼠,为机制探索和药物开发提供了关键平台。例如,布伦科与拉姆斯德尔通过研究scurfy突变小鼠出现的自发免疫病理表型,成功定位Foxp3基因突变;坂口团队则利用基因敲除模型证实Foxp3为Treg细胞分化与功能维持所必需。 在临床前药效评价阶段,小鼠模型是评估靶向Treg策略有效性与安全性的重要工具。例如,利用氯膦酸盐脂质体清除巨噬细胞的损伤模型,可精准解析Treg与单核/巨噬细胞在肿瘤微环境中的相互作用;人源化小鼠模型则为靶向人源免疫检查点的药效动力学研究提供了跨物种评价平台。这些模型不仅用于验证药物的作用机制,也为联合治疗策略(如Treg靶向药物与抗PD-1抗体、代谢抑制剂或双特异性抗体联用)提供了机制研究平台。 为满足针对Treg靶点的新药研发需求,集萃药康已开发多种可用于免疫肿瘤学研究的基因人源化小鼠模型与免疫重建模型。这些临床前研究工具能够模拟人体肿瘤免疫微环境及免疫系统特征,为候选药物从早期靶点验证到临床前药效与安全性评价提供系统、可靠的实验数据支持。 表2. 集萃药康相关人源化小鼠 表3. 集萃药康免疫重建小鼠 结语 2025年诺贝尔奖对Treg细胞研究的认可,突显了动物模型在推动临床医学进步中的重要地位。从胸腺切除模型到基因编辑小鼠,从scurfy小鼠到人源化免疫系统模型,以小鼠模型为代表的实验动物模型为Treg生物学机制的解析及靶向药物的开发提供了不可或缺的平台。随着单细胞测序、空间转录组与基因编辑技术的不断融合,Treg靶向治疗正迈向更精准、更可控的新阶段,有望为肿瘤和自身免疫性疾病提供全新的治疗解决方案。 [1]J Immunol. 1995 Aug 1;155(3):1151-64. [2]Nat Genet. 2001 Jan;27(1):68-73. [3]Science. 2003 Feb 14;299(5609):1057-61. [4]https://m.163.com/dy/article/K9JT124J0532CO9S.html [5]10.1016/j.immuni.2025.03.021 [6]Cancer Metastasis Rev. 2015 Jun;34(2):277-90. [7]Nature . 2025 Jun;642(8066):191-200. [8]Invest New Drugs. 2022 Dec;40(6):1333-1341. [9]Nat Cancer. 2020 Dec;1(12):1153-1166. [10]Cureus. 2020 Jun 13;12(6):e8602. [11] Cancer Res Commun. 2025 Mar 1;5(3):422-432. [12] J Immunother Cancer. 2021 Jul;9(7):e002591.核心发现时间轴:
Treg细胞的身份标识:Foxp3依赖性与亚群分类
Foxp3:Treg细胞的谱系决定因子
功能亚群:nTregs与iTregs的分化与定位
Treg细胞分为两类,均依赖Foxp3表达但具有不同起源与功能:
Treg细胞的免疫调节机制:多维度抑制网络
经典靶点的再探索
新兴靶点的突破与临床验证
Treg靶向治疗面临的挑战
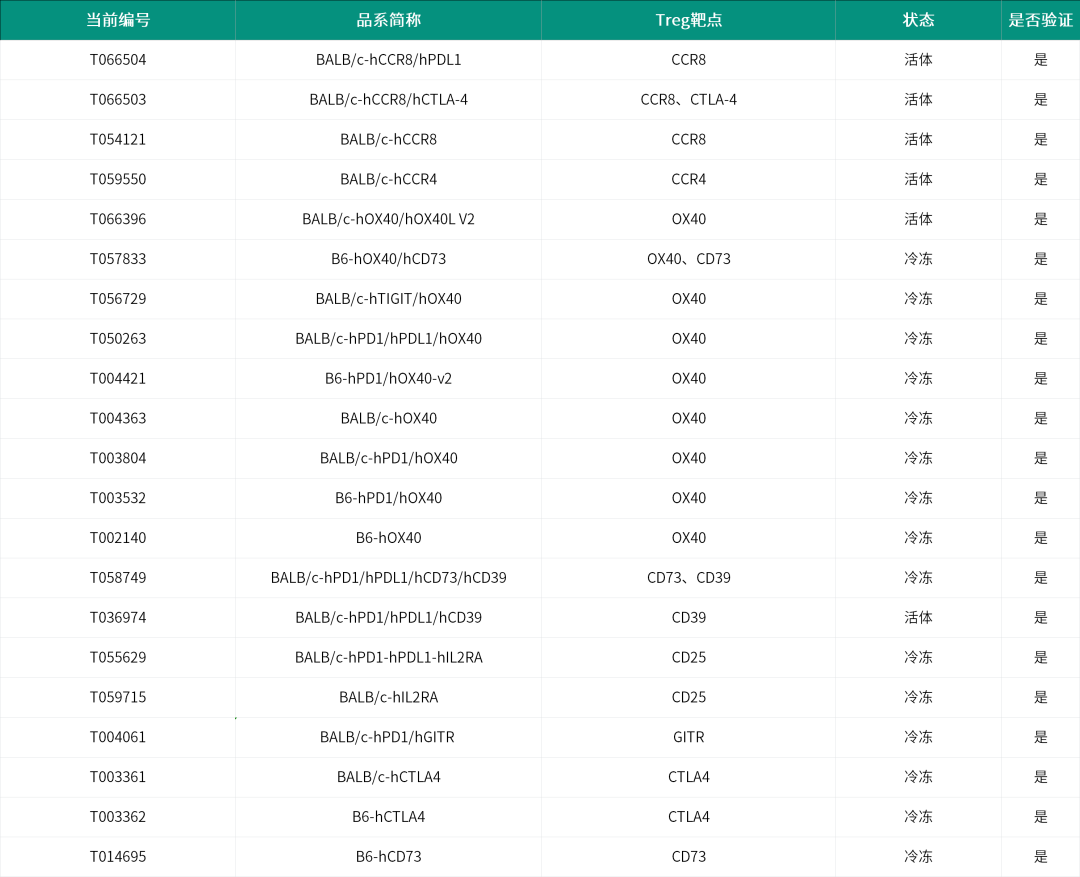
集萃药康部分相关靶点基因人源化小鼠
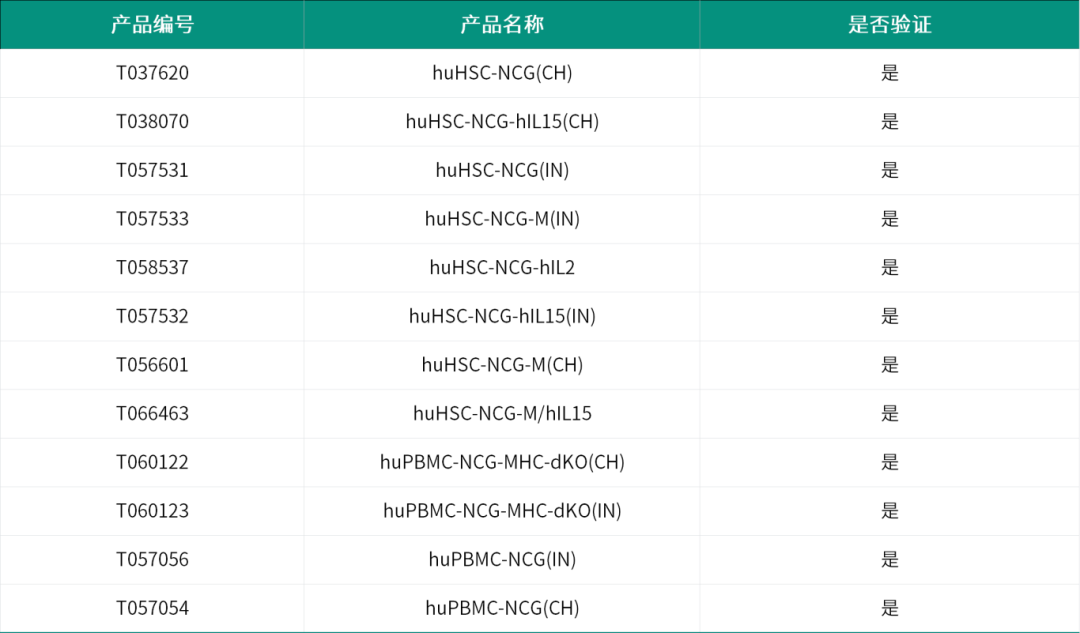
集萃药康部分免疫重建小鼠资源
参考文献