【技术·制剂】破解Protac与分子胶成药难题,凯莱英先进制剂技术赋能靶向蛋白降解药物开发
靶向蛋白降解(TPD)领域正以前所未有的速度重塑新药研发格局。作为该领域的核心策略,蛋白降解靶向嵌合体(Protac)凭借其独特的作用机制——搭建“靶蛋白-PROTAC-E3连接酶”三元复合物,引导细胞自带的蛋白酶体精准降解特定蛋白,从而让原本无法成药的靶点成药。分子胶(Molecular Glue)与Protac的功能类似,但分子量较小,可以拉近靶蛋白和E3连接酶的距离,并诱导靶蛋白的泛素化和降解。
目前,全球研发热情高涨,数百个项目涌入管线,多款Protac药物进入临床后期阶段,首个Protac药物已提交上市申请,多个新一代分子胶药物已进入临床后期阶段,市场潜力巨大。
然而,Protac和分子胶类药物普遍面临溶解性差、口服生物利用度低的核心制剂难题,严重制约其临床转化与商业化进程。凯莱英制剂凭借过硬的增溶技术实力,并依托领先的药物递送和高端制剂技术平台,提供从喷雾干燥、热熔挤出到脂质体、LNP递送及缓释注射剂、纳米晶等多元化的制剂解决方案,为全球合作伙伴扫清TPD药物开发中的制剂障碍。
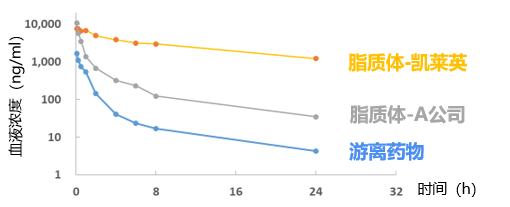
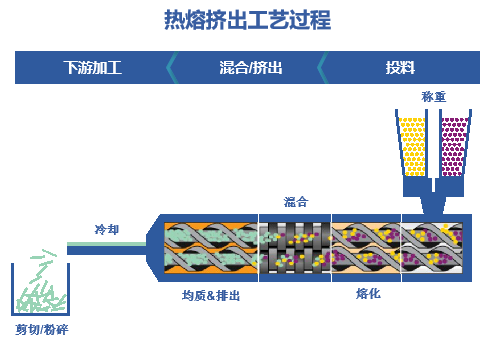
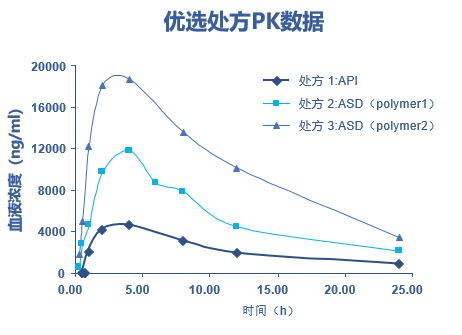
面对药物制剂研发的技术难题,以及市场对高端制剂的迫切需求,凯莱英凭借在制剂领域的积累和开拓,已构建起包括脂质体、核酸LNP、聚合物纳米粒、缓释注射剂、纳米晶(沉淀法)等多元化的创新药物递送技术,并已帮助十余家客户攻克制剂难题,实现数十个复杂制剂项目的交付。 针对Protac、分子胶等难溶性药物,凯莱英制剂团队成功开发了脂质体、纳米乳、PLA纳米粒等多种先进递送系统,可以应用于注射给药领域。Protac注射剂开发常面临溶解度低、体内清除快、体内暴露量不足等主要挑战。凯莱英依托自主搭建的高通量脂质体开发平台,快速筛选并优化处方,显著提升开发效率。 在某案例中,技术团队仅用7天即完成动物实验用脂质体制剂的生产,与游离药物相比,成功将Protac药物体内暴露量提升超400倍,最高耐受剂量提高20倍,为Protac药物的后期开发奠定了基础。 图1. 血中药物浓度曲线 此外,由凯莱英自主开发的流体控制生产系统具备高效工艺放大的优势,能够显著降低药物开发生产成本,适用于脂质体、纳米晶、LNP、PLGA纳米粒等多种高端复杂制剂,进一步强化了公司在创新制剂领域的核心竞争力。 无定形固体分散体(ASD)是改善难溶性药物口服生物利用度最成熟的手段之一。将难溶性药物和高分子材料通过喷雾干燥和热熔挤出等技术制备成ASD,可显著提高难溶性药物的溶解度和溶出速率,进而提高生物利用度。大多数口服Protac药物的难溶性问题均采用ASD技术攻克。 目前,凯莱英无定形固体分散体制剂开发平台可以满足NMPA、FDA、EMA及PMDA等全球主要监管机构的申报要求,成功支持了众多IND和NDA项目的国际申报。凭借丰富的项目经验,团队已累计完成超过100个喷雾干燥及30余个热熔挤出制剂项目,具备从处方开发到商业化的全流程服务能力。 喷雾干燥技术 喷雾干燥(Spray Drying, SD)技术广泛应用于各类难溶性药物的制剂开发与商业化生产,该技术将API与载体共同溶解于溶剂后,经高压雾化形成微小液滴并瞬间干燥,最终得到几十微米级的固体分散体颗粒。该过程融合热力学、流体力学及流变学等多学科原理,因此工艺设计与控制的复杂度较高。 经过多年的深耕积累,凯莱英制剂团队的开发经验已覆盖当前最前沿的药物类型,包括GLP-1小分子、Protac及多肽等,可完全满足多样化的项目需求。针对Protac/分子胶等药物极低溶解度的难题,团队通过筛选高效重结晶抑制聚合物,开发无定形态固体分散体。在某制剂项目中,在极其有限的API消耗及时间限制的条件下(API<10g,时间<2周),攻克难溶化合物生物利用度瓶颈,提供关键解决方案,实现处方中API溶解度相较于纯API提升数倍至数百倍。 在产能方面,配备多台不同规格的喷雾干燥设备,包括小型实验机、中试机型以及大型商业化机型。所有设备均符合cGMP生产标准,支持水和有机溶剂,并可用于OEB4及以下化合物生产,能够为客户提供高效、灵活且合规的喷雾干燥生产服务。 热熔挤出技术 热熔挤出(hot melt extrusion, HME)是利用螺杆挤出机,通过热和机械应力的作用,把API和高分子载体在熔融状态下充分混合,挤出冷却后形成固体分散体。热熔挤出工艺步骤少,投资成本低,且无需溶剂,近年来备受制药行业的关注。 图2. 热熔挤出工艺过程 目前,团队已具备丰富的热熔挤出项目经验。针对具有多晶型且溶解度极低(BCS Ⅱ/Ⅳ类)、热稳定性良好的API,采用热熔挤出(HME)技术开发无定形固体分散体。在某制剂项目中,团队2周内完成聚合物筛选,实现无溶剂消耗与良好工艺重现性,最终ASD制剂显著提升API体内暴露量达5倍,提升效果显著。 图3. 不同处方在血液中的PK结果 注:处方3为最终确定的制剂处方,与纯API相比,其在血液中的溶解度提高近5倍 在产能方面,配备多种型号设备,适用于工艺开发与小批量临床样品生产,以及中试放大与商业化生产。所有设备均符合cGMP要求,并可用于OEB4及以下化合物生产,为创新药制剂开发提供灵活、稳定且高质量的生产保障。 脂质制剂已被证明可以有效提高低水溶性药物的口服生物利用度。脂质制剂可保持药物分子在整个消化过程中呈溶解和过饱和状态,通过提高药物溶解以及避免药物水解,来增加口服吸收。 在脂质制剂的开发方面,制剂团队亦积累了较为丰富的经验。团队采用脂质制剂技术将API溶解于含增溶剂和渗透促进剂的脂质基质中,借助表面活性剂提升药物水中分散性,并利用含酯键的脂质辅料增强肠上皮细胞渗透性;口服后脂质基质可在胃液中形成微乳,实现快速释放。目前,制剂团队已完成近20个脂质处方项目,实现20余临床批次产品供应,满足NMPA与FDA申报标准。 图4. 药物递送和制剂研发中心技术平台 经过多年快速发展,凯莱英制剂平台已具备全面的口服固体制剂、外用制剂、无菌制剂和复杂制剂服务能力,并在难溶性药物的制剂开发领域积累了丰富的开发和应用经验。为进一步提升复杂制剂攻关能力,公司在2020年初成立了药物递送和制剂研发中心,专注于为客户解决更具挑战性的制剂难题。该中心已成功开发了纳米制剂、脂质纳米粒(LNP)、纳米凝胶、温敏凝胶、长效注射剂等多种先进递送技术平台,并已为十余家客户实现技术支持和制剂服务。 未来,制剂平台将进一步加强对靶向蛋白降解等新分子类型药物的服务能力,赋能更多国内外合作伙伴。