9月25日,剂泰科技首席科学官徐伟博士受邀出席医药魔方主办的2025中国医药决策者峰会(2025CHDC)暨中国创新药十年成就巡礼,在“AI激活医药行业创新动能”分论坛做主旨演讲《AI驱动新药研发:药物递送的智能革命》。期间,徐伟博士介绍了剂泰科技自主研发的业内首个AI驱动纳米递送平台NanoForge,并重点分享了在NanoForge驱动“火箭(LNP)+卫星(mRNA)”的创新范式下,管线产品MTS105取得的重要突破。
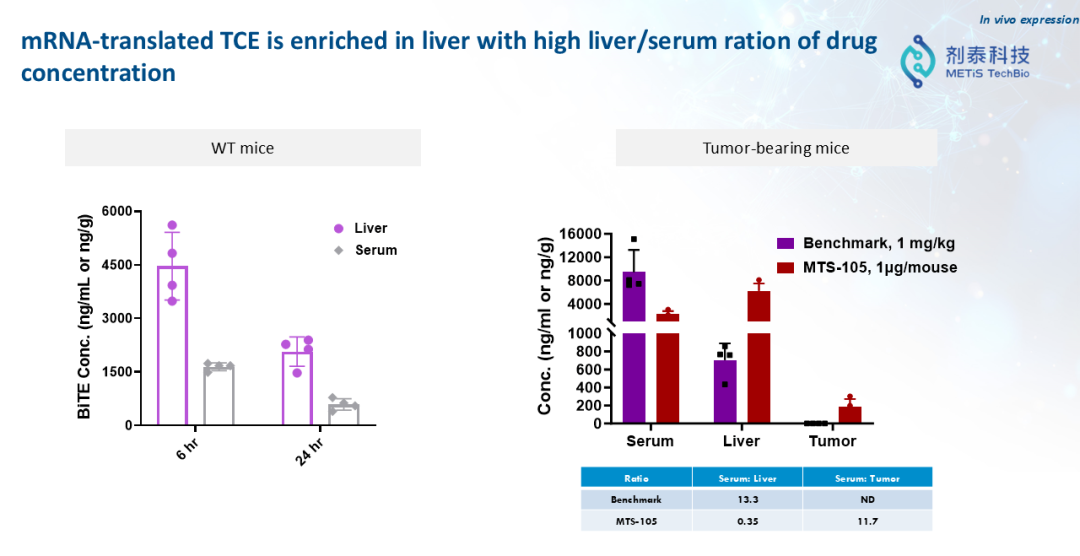
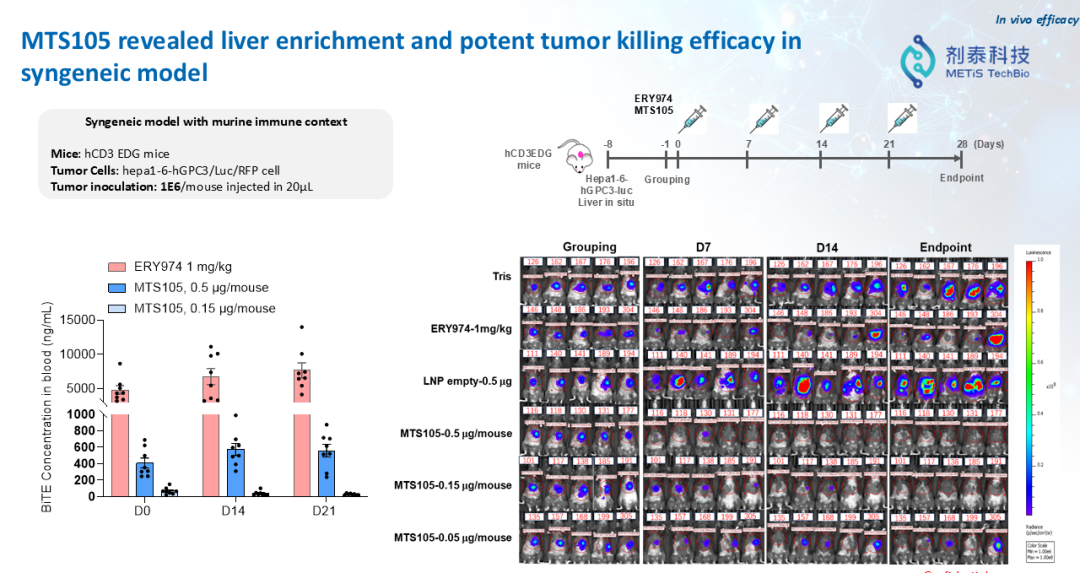
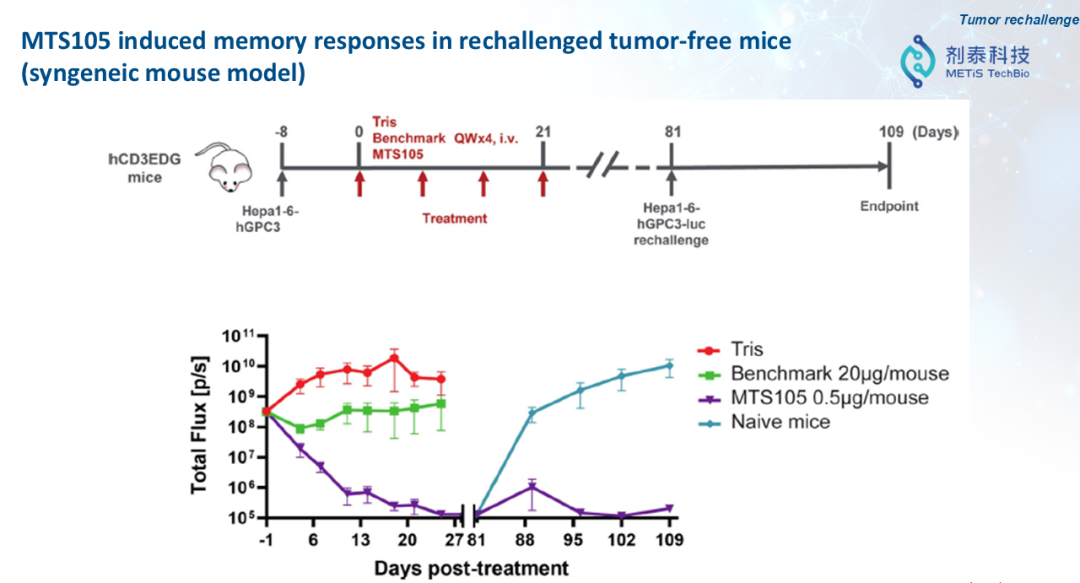
“如果把药物比作卫星,那么我们需要找到能够进入体内的‘纳米火箭’,精准将药物递送到目标细胞。药物开发的核心挑战就在于精准递送。” 徐伟博士讲到,“一个好的递送系统可以重新定义mRNA药物。我们现在很多免疫治疗的抗体药,打进去以后,只有低于1%的抗体能够真正打到组织里面去。但是如果我们通过LNP的递送,把mRNA在体内翻译成蛋白药物,它的效率将几百倍地提升。”剂泰MTS105:AI驱动“火箭+卫星”的研发新范式剂泰科技MTS105是一款基于mRNA的T细胞衔接器(TCE)候选药物,也是剂泰科技用“火箭+卫星”的范式解决实体瘤重大痛点的案例。通过剂泰科技自主开发的肝靶向LNP(脂质纳米颗粒)实现肝脏精准递送,有望成为全球首款实体瘤治疗的mRNA编码TCE疗法。“这个产品当初为什么这样设计?因为我们找到了业内最佳(Best in Class)靶向肝脏的LNP。”徐博讲到,“有了这个精准递送到肝脏的‘火箭’,我们想到同时开发‘卫星’,在肝脏里面表达我们想要的蛋白。我们设计了一个T-cell engager双抗分子,在肝脏里面表达出来,甚至在肝脏肿瘤里面表达出来。双抗分子可以一端激活T细胞,另外一端结合肿瘤细胞的抗原,从而在肿瘤内部激活T细胞来杀伤肿瘤。”MTS105的研发采用了希腊神话中希腊联军攻克特洛伊城的战术,透过精准的LNP递送系统,穿透实体瘤的坚固的外部城墙,直接在实体瘤内部和它的周围大规模部署杀伤肿瘤的TCE,从内部将其瓦解,实现下一代TCE治疗的更强安全性和更好疗效,甚至有望超越体内CAR-T。因为这一方式能够超越实体瘤的屏障,达到精准治疗的目的。而这一战役的关键正是精准递送的能力。1,MTS105小鼠实验显示,mRNA翻译生成的T细胞衔接器在肝脏中高度富集,具有显著的肝脏/血清药物浓度比优势。2,MTS105在同源模型中显示出肝脏富集特性及强效肿瘤杀伤活性。小鼠实验数据显示,在剂量低至0.15微克时,MTS105即可实现100%的完全缓解(Complete Response),其外周药物暴露量仅为蛋白抗体TCE的1/10,疗效显著优于直接注射蛋白抗体的对照组。3,MTS105在无瘤小鼠(同源模型)中诱导了再次攻击后的记忆应答,在小鼠再次接种相同肿瘤细胞后,肿瘤没有重新生长,显示出潜在的持久防复发能力。