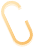41 万例 TAVR 数据揭示:为何 “全生命周期管理” 刻不容缓?
随着经导管主动脉瓣置换术(TAVR)在低危、年轻患者中的普及,临床医生关注的焦点正从 “如何成功完成首次置换” 转向 “如何让患者长期获益”。近期发表在《JAMA Cardiology》的一项回顾性研究,基于美国 CMS 数据库 2012-2024 年的真实世界数据(涵盖 410,720 例 TAVR 和 299,780 例SAVR),首次系统性呈现了主动脉瓣再干预的流行趋势与时间规律 —— 这些数据不仅回答了 “再干预有多常见”,更为我们敲响了 “全生命周期管理” 的警钟。
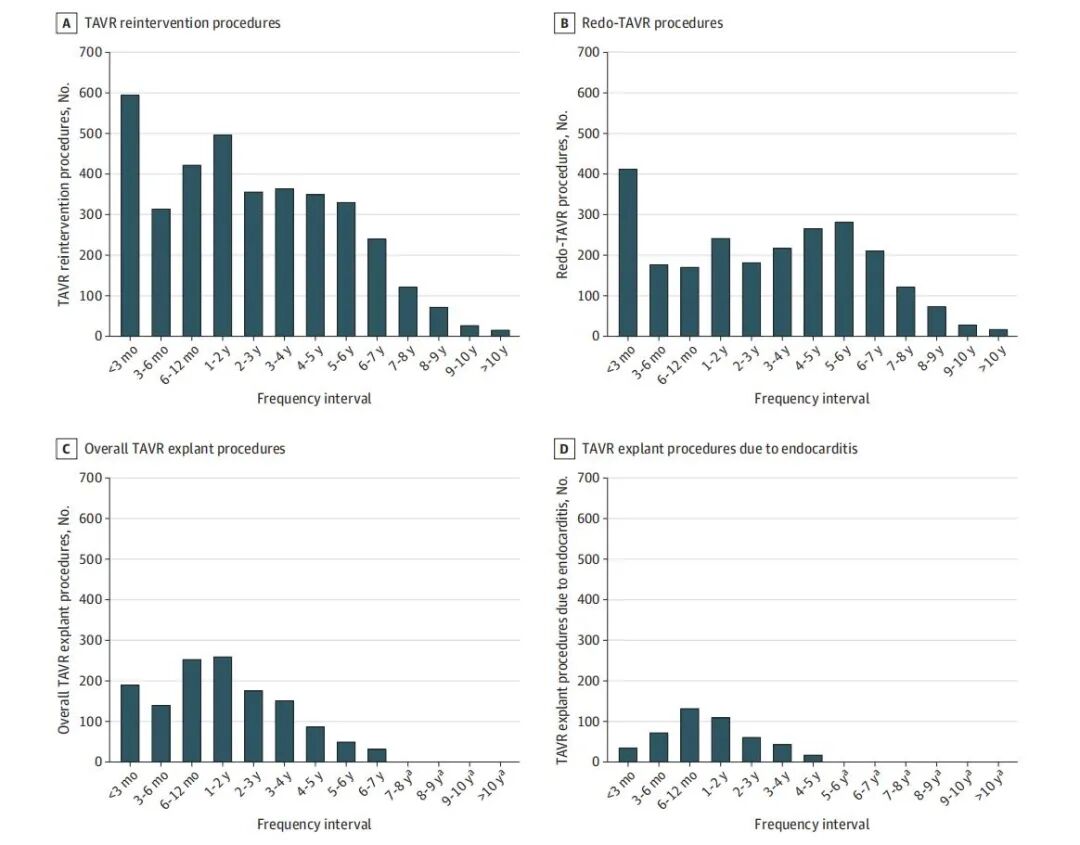
12年41万例TAVR中,仅3720例需再干预(总体发生率0.91%),细分两类: 再次TAVR(redo TAVR):2374例,占再干预总量63.8%; TAVR 取出术(TAVR explant):1346例,占再干预总量36.2%。 年发生率持续升高:低风险患者2019年0.17% → 2023年0.28% 近期占比 “爆发式上升”:2020-2024 年(含部分数据)的redo TAVR占12年总量63.9%,TAVR explant占72.8%; 2024 年半年数据 “年化后”:redo TAVR年手术量568例、TAVR explant284例,较2019年(176例、91例)近乎翻倍。 指南推荐:ACC/AHA 指南建议65岁以下非高危患者优先选SAVR; 临床现状:美国近50%年轻患者仍选择TAVR; 核心隐患:生物瓣会随时间退化(如瓣叶钙化、反流),年轻患者术后存活越久,未来再干预需求越高。
图1:经导管主动脉瓣置换术(TAVR)及 TAVR 再干预手术的年手术量
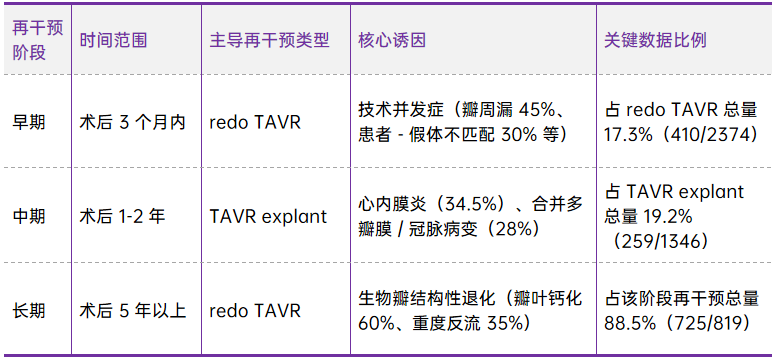
研究首次用表格清晰划分“早期、中期、长期” 三个阶段,每个阶段的 “主导再干预类型、核心诱因、关键比例” 均有明确数据,是术后随访的 “精准靶点”:也是第一次有TAVR术后的真实世界数据可以看到长久衰败的原因: 88.5% 的长期再干预(术后 5 年以上)由SVD导致。
图2:A. 所有在不同时间间隔内进行的经导管主动脉瓣置换术(TAVR)再干预情况(以首次TAVR为基准)。B. 在不同时间间隔内实施的TAVR再次手术数量(以首次TAVR为基准)。C. 所有在不同时间间隔内进行的TAVR移植物取出数量(以首次TAVR为基准)。D. 因心内膜炎在不同时间间隔内实施的TAVR移植物取出数量(以首次TAVR为基准)。
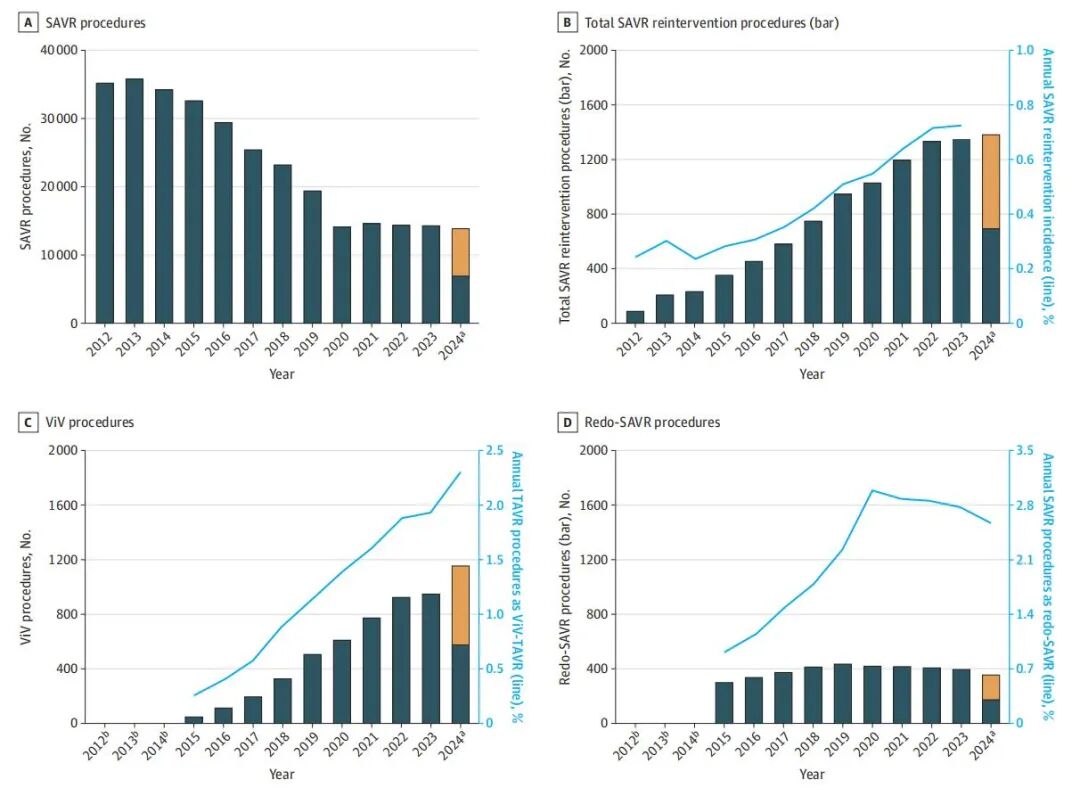
再干预类型分布:29.9 万例 SAVR 中,5044 例(1.68%)接受瓣中瓣 TAVR(ViV-TAVR),4202 例(1.40%)接受再次 SAVR(redo SAVR);
ViV-TAVR:年手术量逐年升高,2024 年年化 1036 例(2019 年仅 320 例);
redo SAVR:年手术量逐年下降,2024 年年化 356 例(2019 年为 890 例);
SAVR 术后再干预已进入 “微创时代”,且和 TAVR 一样,需长期监测瓣膜功能