迷幻药物通过细胞内5-HT2A受体激活促进神经可塑性:重塑抑郁症治疗新范式
在精神疾病治疗领域,传统抗抑郁药物如选择性5-羟色胺再摄取抑制剂(SSRIs)虽广泛应用,但存在起效延迟、有效率有限及副作用显著等问题,尤其对难治性抑郁症患者效果不佳。近年来,氯胺酮和经典迷幻药物在临床试验中展现出快速、持久的抗抑郁疗效,但其分子机制始终未明。
加州大学戴维斯分校David E. Olson团队于《Science》发表的突破性研究首次揭示,迷幻药物如5-甲氧基-N,N-二甲基色胺(5-MeO-DMT)和裸盖菇素并非通过细胞膜表面的5-羟色胺2A受体(5-HT2AR)发挥作用,而是直接激活细胞内池中的该受体,从而驱动树突发生、棘突发生和功能性神经环路重塑。这一发现不仅解开了“为何同为5-HT2AR激动剂,迷幻药物有效而内源性5-HT无效”的长期谜题,更为开发非致幻性神经可塑性促进剂提供了精准靶点,有望彻底变革抑郁症等精神疾病的治疗格局。
研究背景:传统抗抑郁药的局限与迷幻药物的潜力
传统SSRIs通过阻断5-HT再摄取提升突触间隙5-HT浓度,但需数周方能起效,且约三分之一患者治疗无效,其瓶颈在于5-HT主要激活细胞膜表面受体,而未能触及细胞内信号网络;与之对比,单次剂量迷幻药物即可在24小时内诱导持续的神经可塑性变化,且临床研究显示其对耐药性抑郁症有显著缓解作用,但既往机制研究多聚焦于膜受体信号,忽略了细胞内区室的关键作用。Olson团队提出假说:迷幻药物的促神经可塑性效应可能源于其穿透细胞膜的能力,从而激活细胞内5-HT2AR,而高极性的5-HT因无法被动扩散进入细胞,导致其虽能激活膜受体却无法触发结构性重塑。
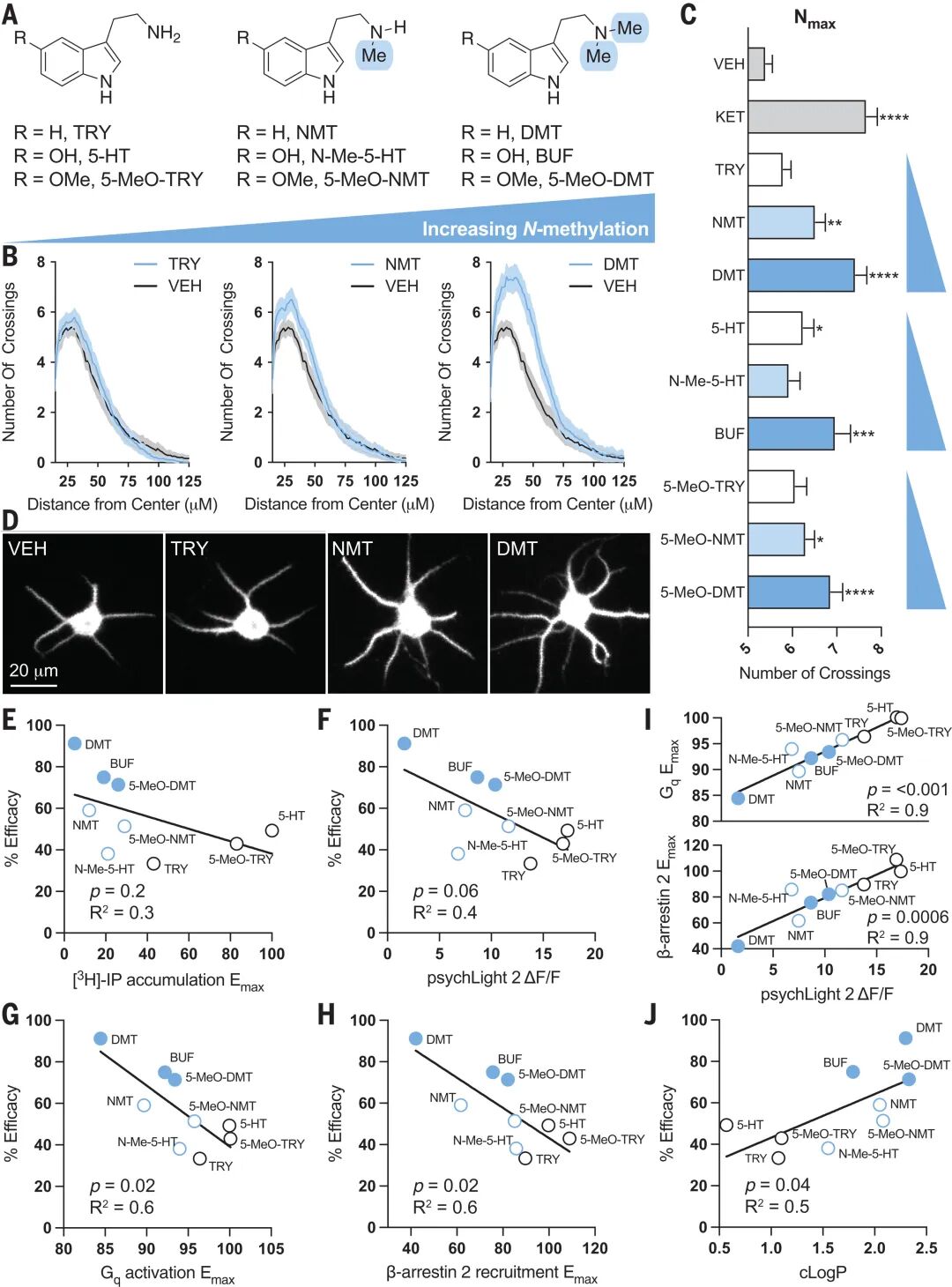
核心发现一:神经可塑性依赖5-HT2AR激活且与配体透膜性相关
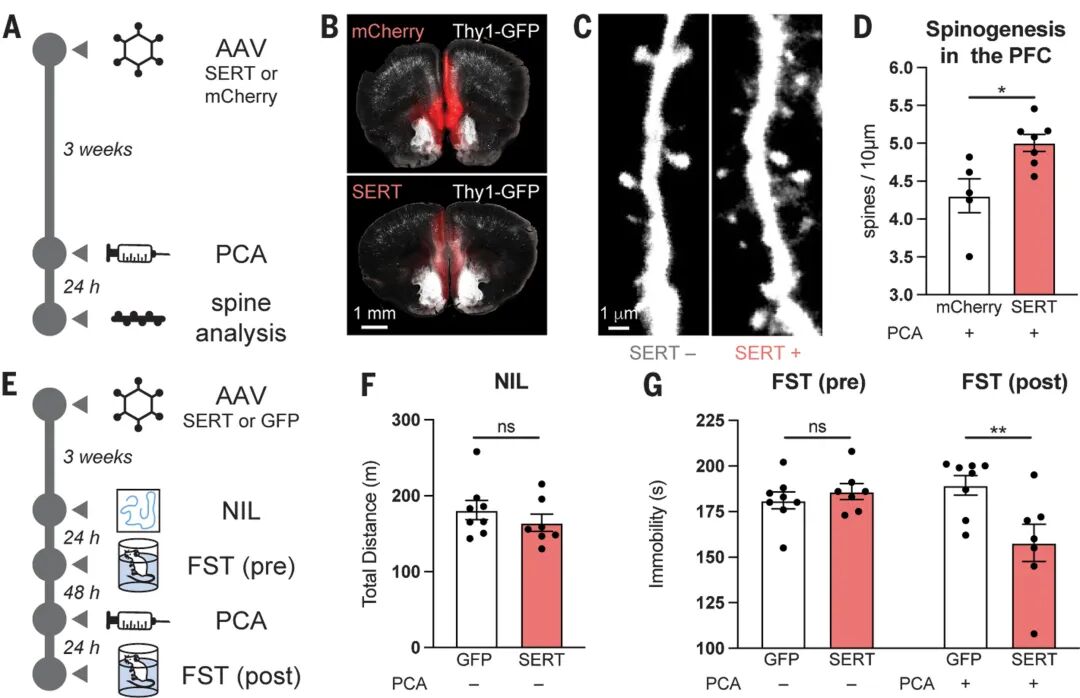
通过野生型与5-HT2AR基因敲除小鼠的对比实验,研究证实致幻剂5-MeO-DMT可显著增加前额叶皮层树突棘密度和自发兴奋性突触后电流频率,该效应在敲除模型中完全消失,明确了5-HT2AR的必要性;进一步结构-活性关系研究显示,随着色胺类配体N-甲基化程度增加,其计算脂水分配系数(cLogP)升高(亲脂性增强),促神经可塑性能力同步增强,且cLogP与神经生长效应的相关性(R²=0.5)远高于其与Gq蛋白激活或β- arrestin招募的相关性,提示配体透膜能力而非信号偏向性是决定神经可塑性的关键因素。
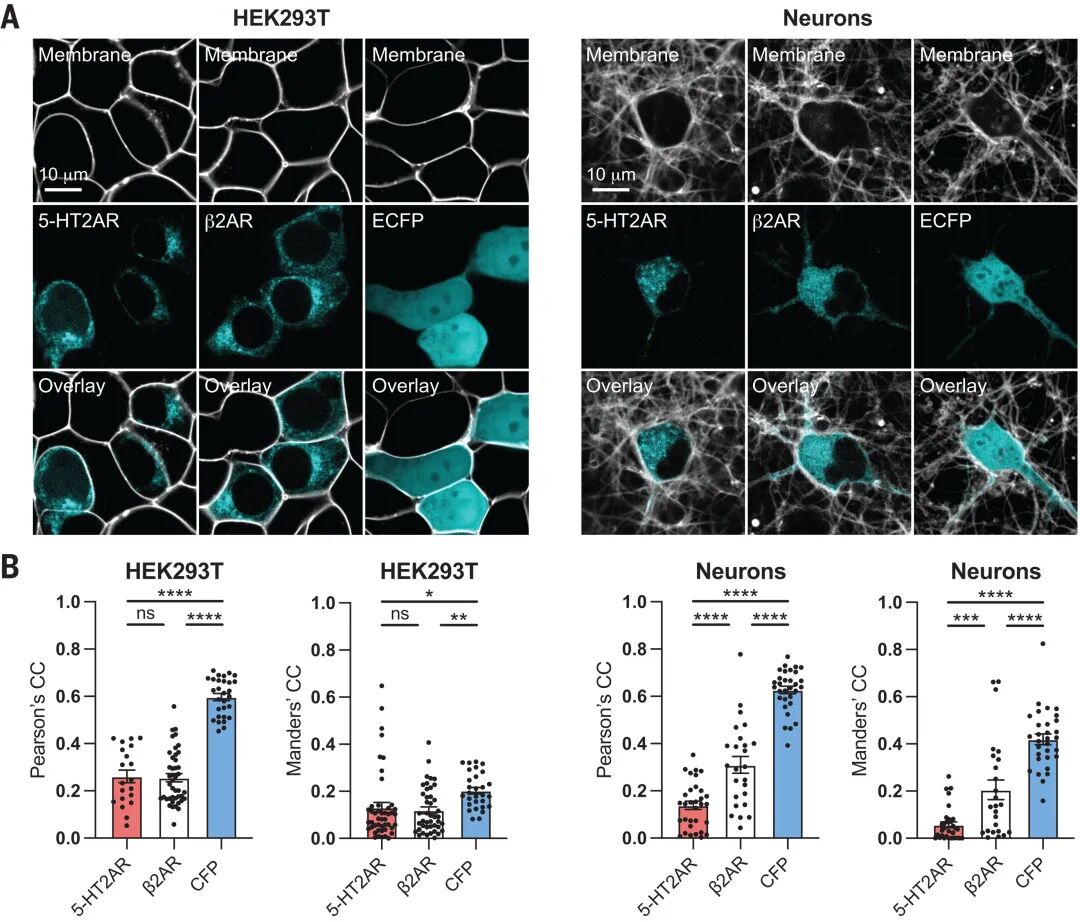
核心发现二:皮质神经元内5-HT2AR主要定位于细胞内区室
利用活细胞成像、免疫荧光共定位及亚细胞器标记技术,团队发现5-HT2AR在皮质神经元中主要分布于高尔基体、早期内体等细胞内结构,而非细胞膜;在无血清培养条件下,5-HT2AR与膜标志物共定位程度显著低于β2-肾上腺素受体等膜主导GPCR,且神经元内5-HT2AR与高尔基体标志物GM130的共定位系数高达0.7以上,证实其细胞内池的生理相关性。通过对比原生与过表达受体定位,研究排除了表达量对空间分布的影响,确证了5-HT2AR内在特性驱动其细胞内富集。
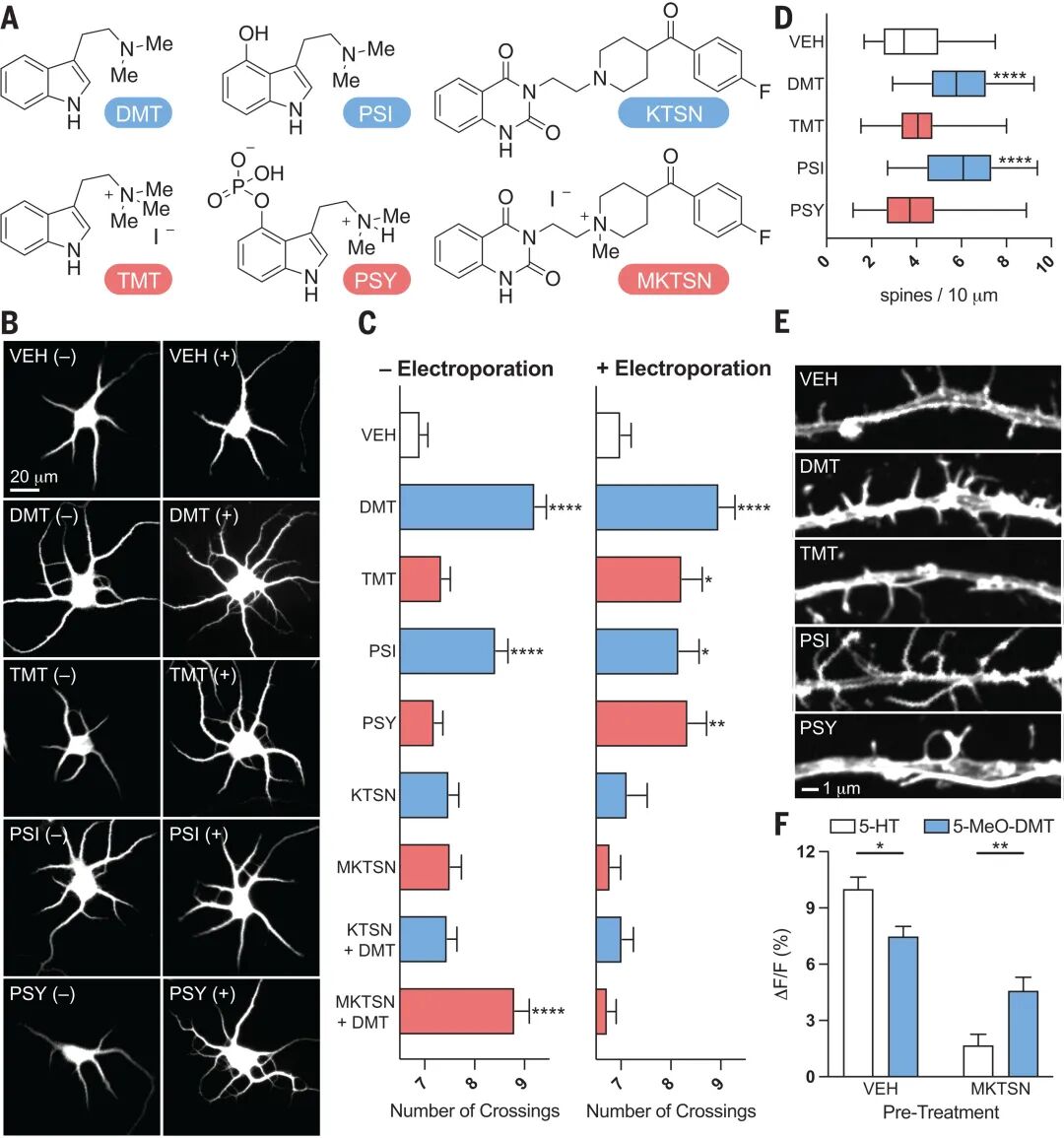
核心发现三:配体透膜性是激活细胞内受体并诱导神经生长的前提
团队设计膜不可渗透配体(如N,N,N-三甲基色胺TMT和甲基化酮色林MKTSN)与原始可渗透配体(如DMT和酮色林KTSN)的对比实验:在常规培养中,可渗透配体均显著促进树突复杂性增加和棘突生成,而不可渗透配体仅在电穿孔强制胞内递送时生效;同样,可渗透拮抗剂KTSN能阻断DMT的促生长作用,而MKTSN需电穿孔方可拮抗。通过PsychLight1传感器实验,团队进一步证明膜不可渗透拮抗剂可完全阻断5-HT对膜受体的激活,但仅部分抑制5-MeO-DMT对细胞内受体的作用,明确将效应定位于胞内区室。
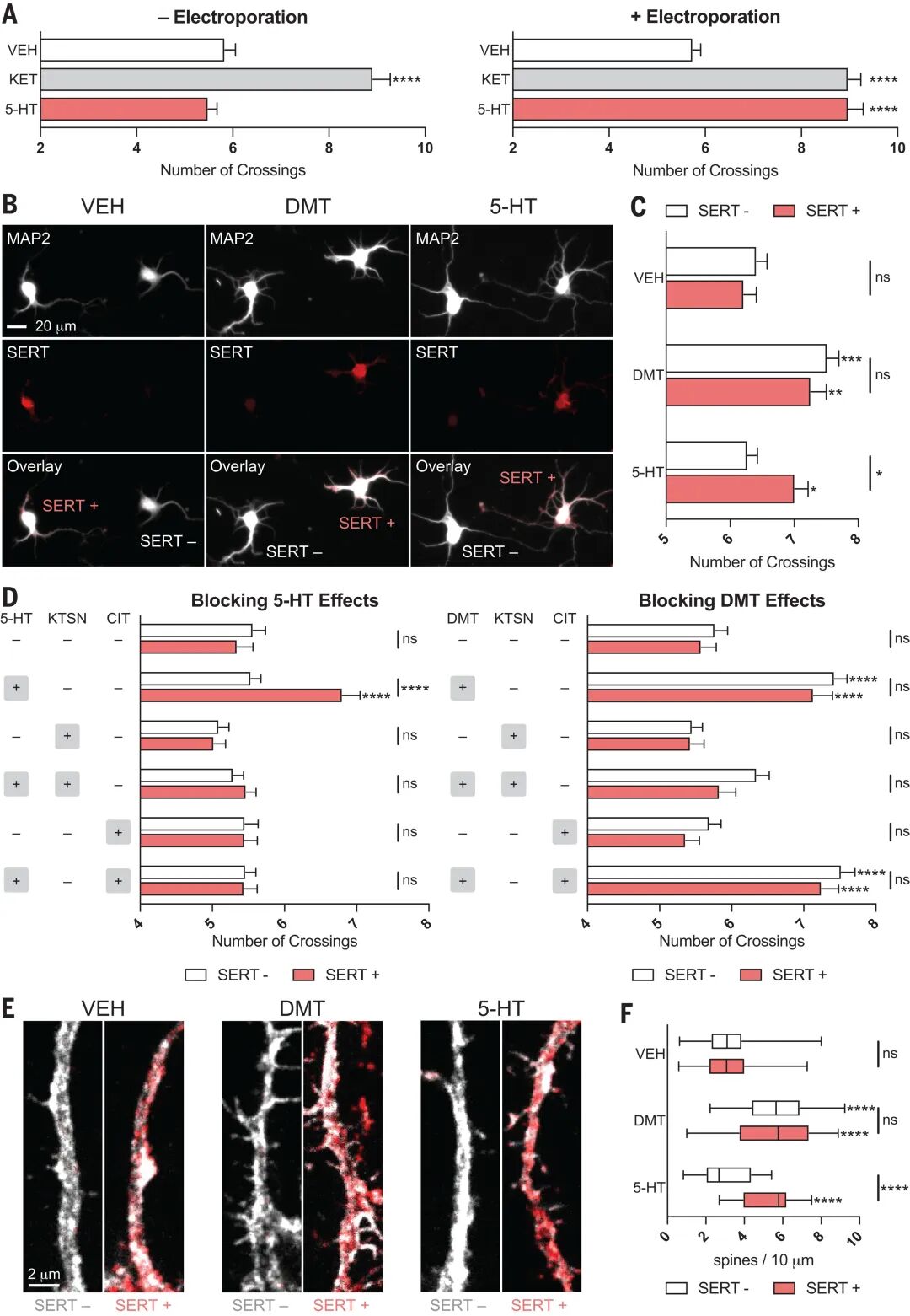
核心发现四:5-HT依赖SERT内化才能激活细胞内5-HT2AR并发挥抗抑郁效应
研究通过稀疏转染技术在皮质神经元中表达血清素转运蛋白(SERT),发现不可渗透的5-HT仅能在SERT阳性神经元中诱导神经生长,且该效应可被SERT抑制剂西酞普兰阻断,而可渗透的DMT在SERT阳性和阴性神经元中均有效且不受西酞普兰影响;在体实验中,于小鼠前额叶皮层表达SERT可显著增强5-HT释放剂对氯安非他命(PCA)的效应,表现为树突棘密度增加、强迫游泳试验不动时间缩短及抗抑郁样行为,该过程依赖5-HT2AR激活。这些结果揭示了SERT介导的5-HT内化是激活细胞内受体并触发下游神经可塑性通路的必要条件。
机制解析:细胞内5-HT2AR信号驱动神经可塑性的通路
细胞内5-HT2AR激活后,通过Gq蛋白偶联通路启动磷脂酶C-β信号级联,促进肌醇三磷酸和二酰甘油生成,进而激活蛋白激酶C并调控钙离子释放;下游信号涉及脑源性神经营养因子表达上调、mTOR通路活化及细胞骨架蛋白重组,最终导致树突分枝扩展、棘突形成和突触功能增强。与膜受体信号相比,细胞内受体激活可持续数小时至数天,且独立于β- arrestin通路,这可能解释迷幻药物单次给药即可引发持久结构重塑的原因,同时为规避致幻副作用提供方向。
临床意义:从致幻剂到非致幻性神经塑化剂的转化
本研究阐明了迷幻药物快速抗抑郁作用的细胞机制,并为开发非致幻性类似物奠定基础:通过优化配体透膜性(如cLogP>0)和靶向细胞内受体,可保留促神经可塑性效应同时减少感知干扰;目前已有TBG等非致幻类似物进入临床前研究,显示类似疗效而无致幻作用。
对临床医生而言,这一进展强调了对受体亚细胞定位功能的关注,并在处方SSRIs时需考虑其可能通过抑制SERT间接限制5-HT内化,从而延缓疗效,未来或可联合SERT激动策略增强治疗效率。
未来展望:靶向细胞内GPCR的精神疾病治疗新纪元
未来研究需聚焦于细胞内5-HT2AR的组织特异性分布、与其它GPCR的相互作用及其在神经退行性疾病中的作用;技术层面,开发亚细胞器特异性递送系统(如纳米载体或病毒工具)可实现对细胞内受体的精确调控。
对于医生群体,此研究提示在评估抗抑郁策略时,应整合受体空间分布与配体药代动力学参数,推动个体化治疗;同时,针对细胞内GPCR的药物设计原则可扩展至其他精神疾病领域,如焦虑症、创伤后应激障碍等。
结论
Olson团队的研究颠覆了既往对5-HT2AR信号范式的认知,将细胞内受体确立为精神疾病治疗的新靶标,其价值在于揭示了神经可塑性促进的细胞基础,并为开发速效、长效抗抑郁药物提供了理论依据。随着对细胞内GPCR网络的深入探索,我们有理由预见,下一代神经塑化剂将以精准靶向、非致幻的特性,为亿万抑郁症患者带来希望之光。
参考文献
Maxemiliano V. Vargas et al.,Psychedelics promote neuroplasticity through the activation of intracellular 5-HT2A receptors.