新药速递 | 美国FDA加速批准首个且唯一一个治疗极罕见脑胶质瘤新药Modeyso (dordaviprone)上市
FDA 加速批准 Modeyso (dordaviprone) 用于治疗复发性 H3 K27M-突变型弥散性中线胶质瘤。
2025年8月6日,Jazz Pharmaceuticals plc宣布,美国食品药品监督管理局(FDA)已授予 Modeyso (dordaviprone)加速批准,用于治疗1岁及以上患有携带H3 K27M突变且既往治疗后病情进展的弥漫性中线胶质瘤的成人和儿童患者。该适应症的持续批准可能取决于III期ACTION确证性试验中对临床获益的验证和描述。
Modeyso是美国FDA批准的首个且唯一的治疗方案,用于治疗这种极为罕见且侵袭性强的脑瘤,每年在美国约有2000人受其影响,其中许多为儿童和年轻成人。该疾病的特点是进展迅速,历史上一直缺乏有效的全身性治疗手段。
“这是神经肿瘤学领域的一个重大转折点,”Dana-Farber癌症研究所神经肿瘤中心主任、哈佛医学院神经病学教授 Patrick Wen 医学博士表示,'我们首次获得 FDA 批准用于复发 H3 K27M 突变弥漫性中线胶质瘤患者的疗法。尽管许多患者的治疗结果仍具挑战性,但 dordaviprone 观察到的客观缓解(包括部分患者的持续获益)代表着具有意义的进步。该疗法的研发基于肿瘤的基础生物学特征,为这个历史上治疗选择极其有限的群体提供了新的治疗选项。'
Modeyso 采用口服胶囊形式,每周给药一次。FDA 的批准决定基于对 50 例复发性 H3 K27M 突变弥漫性中线胶质瘤患者的综合疗效分析,这些患者根据预设资格标准从五项开放标签临床研究中筛选得出。根据采用神经肿瘤学反应评估(RANO)2.0 标准的盲态独立中心评审(BICR)评估,总缓解率(ORR)为 22%(95% CI:12-36),另有 1 例缓解者通过整合 RANO 2.0 标准确认。缓解者的中位缓解持续时间为 10.3 个月(95% CI:7.3-15.2),其中 73%的患者缓解持续时间至少 6 个月,27%的患者至少维持 12 个月。
'FDA 批准 Modeyso 对于长期需要新治疗选择的患者和家庭、不懈寻求解决方案的临床医生以及永不放弃的研究人员和倡导者来说,都是一个里程碑式的时刻,'爵士制药旗下 Chimerix 公司首席科学官 Joshua E. Allen 博士表示。'我们很自豪能够提供我们所追求的这种变革性创新,并对我们 Chimerix 和爵士制药的联合团队以及为推进这一治疗而不懈努力的各界人士表示祝贺。这一批准不仅为临床医生提供了针对该疾病的第一个靶向治疗方案,还标志着患者和家庭在诊断后可以期待的重大转变。我们要向使这一切成为可能的患者、倡导者、临床医生、主要研究者、科学家、监管机构和合作伙伴机构表示衷心的感谢。'
“对于受 H3 K27M 突变弥漫性中线胶质瘤影响的家庭而言,这一获批代表了一个期待已久的治疗选择,'美国国家脑肿瘤协会主席兼首席执行官 David F. Arons 表示,'这是一种进展迅速、破坏性极强的疾病,彻底颠覆了患者家庭的生活。多年来,这一诊断始终缺乏获批准的治疗方案,而今天,这一现状终于改变。患者家庭终于获得了治疗选择,也有了更多理由相信能争取更多相处时光,创造原本可能无法实现的珍贵回忆。'
Modeso 的安全性在四项开放标签临床研究中接受了 376 名成人及儿童胶质瘤患者的评估。33%的患者出现了严重不良反应。发生率超过 2%的严重不良反应包括脑积水(5%)、呕吐(4.3%)、头痛(3.2%)、癫痫发作(2.4%)和肌无力(2.1%)。接受 Modeso 治疗的患者最常见(≥20%)不良反应为疲劳、头痛、呕吐、恶心和肌肉骨骼疼痛。
关于 H3 K27M 突变弥漫性中线胶质瘤
H3 K27M 突变弥漫性中线胶质瘤是一种罕见且高度侵袭性的脑肿瘤,主要影响脑和脊髓的中线结构。其特征是特定的基因突变(H3 K27M),该突变会破坏表观遗传调控并驱动肿瘤生长。这种胶质瘤最常见于儿童和年轻成人,患者通常面临极为不良的预后,治疗选择有限,复发后生存率极低。自诊断起中位生存期约为一年,一线治疗后病情进展后的生存期不足六个月。
关于 Modeyso(dordaviprone)
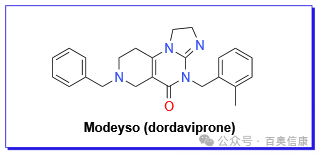
美国FDA批准 Modeyso(dordaviprone)用于治疗经既往治疗后疾病进展、携带 H3 K27M 突变的 1 岁及以上成人及儿童弥漫性中线胶质瘤患者。Modeyso 是一种每周口服一次的小分子药物,作为线粒体酪蛋白水解蛋白酶 P(ClpP)的蛋白酶激活剂,同时可抑制多巴胺 D2 受体(DRD2)。体外研究表明,dordaviprone 可激活整合应激反应,诱导细胞凋亡,改变线粒体代谢,从而恢复 H3 K27M 突变型弥漫性胶质瘤中的组蛋白 H3 K27 三甲基化。
Modeyso(dordaviprone)基于对 50 例复发性 H3 K27M 突变弥漫性中线胶质瘤成人和儿童患者的预设整合疗效分析获得加速批准,这些患者来自五项开放标签临床研究(ONC006、ONC013、ONC014、ONC016 和 ONC018)。持续批准可能取决于正在进行的 3 期 ACTION 试验(NCT05580562)中对临床获益的验证与描述,该试验正在评估 Modeyso 在新诊断 H3 K27M 突变弥漫性胶质瘤患者放疗后的安全性和临床获益。6 Modeyso 由 Chimerix 公司开发,后于 2025 年 4 月被 Jazz Pharmaceuticals 收购。
Modeyso(dordaviprone)尚未在全球其他任何地区获得批准。
关于Jazz Pharmaceuticals
Jazz Pharmaceuticals是一家全球性生物制药企业,致力于通过创新改变患者及其家人的生活。Jazz专注于为患有严重疾病(通常治疗选择有限或缺乏)的人群开发可能改变生命的药物。Jazz拥有多元化的上市药物组合,包括治疗睡眠障碍和癫痫的领先疗法,以及不断增长的癌症治疗产品线。以患者为中心、科学驱动的理念推动着我们在肿瘤学和神经科学领域强大的创新治疗药物研发管线取得突破性进展。Jazz Pharma总部位于爱尔兰都柏林,在多个国家设有研发实验室、生产基地和员工团队,致力于为全球患者服务。
✦ 关于我们 江苏百奥信康医药科技有限公司是一家以新药研发驱动制药全产业链发展的高科技创新型医药企业。公司以研发自我持有的改良型新药和高端特色仿制药产品为主业,构建核心技术平台,同时为国内外客户提供新药和仿制药产品的研发服务。 百奥信康致力于做中国最成功的改良型新药! 百奥信康 百奥信康,以研发自我持有的新药产品为主业,构建核心技术平台,着眼于全球化市场,本着开放合作的心态,秉持同心协力众